䃆:修订间差异
imported>Wenglizi 创建页面,内容为“361号元素䃆,元素符号Wq,鹰纹名Weiqine,电子排布式[Sjb]7h²²8g¹⁸9f¹⁴10d¹⁰11s²11p⁵,常温下是棕色固体<ref>https://tieba.baidu.com/p/7566035067</ref> 熔点:361C=634.15K=681.8F 沸点:6499C=6772.15K=11730.2F 密度:23g/cm³ 电负性:1.87 电离能: I1=361 I2=2021 I3=6789 I4=25051 I5=100001 I6=419430 I7=1919810 原子半径:5 Å 硬度:4 人们不清楚䃆是卤素还是半金属,因为它的…” |
imported>Hydrogen Sulfide |
||
| (未显示5个用户的24个中间版本) | |||
| 第1行: | 第1行: | ||
{{NOWiki}} | |||
{{元素信息|名称=䃆(鹰纹名Weiqine)|原子序数=361|熔点=361°C(634.15K,681.8°F)|沸点=6499°C(6772.15K,11730.2°F)|密度=23g/cm<sup>3</sup>|硬度=4|常见化合价=常见价态-1,0(䃆化钴,䃆化镍,䃆化铜,䃆化锝,䃆化铼),+1,+2,+3,+4,+5,+7,其他价态-3,+6 | |||
-3几乎不可能|image1=0e866dd9f2d3572c4b41df31cf13632763d0c317.jpg|符号=Wq|原子半径=5 Å|硬度=4|电负性=1.87}} | |||
'''䃆'''(Weiqine)是361号元素,符号Wq,电子排布式[<nowiki></nowiki>[[气革|Gh]]]7h<sup>22</sup>8g<sup>18</sup>9f<sup>14</sup>10d<sup>10</sup>11s<sup>2</sup>11p<sup>5</sup>,单质是棕色固体。<ref>https://tieba.baidu.com/p/7566035067</ref>䃆的电负性很低,所以表现得与金属类似,能与酸反应,且它的氢化物里氢带负电,所以制取䃆化物只能直接化合。䃆最常见的化合价就是-1价,化合物包括大多数金属䃆化物。 | |||
==常见化合价下的性质== | |||
=== 䃆的+1价 === | |||
[[File:次䃆酸钠.jpg|缩略图|次䃆酸钠]] | |||
䃆的+1价主要化合物有WqX (X=F, Cl, Br, I, H, OH, NO<sub>3</sub>)、Wq<sub>2</sub>X (X=O, S, SO<sub>4</sub>)以及Wq<sub>3</sub>N和CWq<sub>4</sub>。 | |||
[[File:次䃆酸.jpg|缩略图]] | |||
先介绍次䃆酸(WqOH,又称氢氧化䃆),结构Wq-O-H | |||
次䃆酸是两性化合物,存在两种电离: | |||
WqOH⇌WpO<sup>-</sup>+H<sup>+</sup> | |||
WqOH⇌Wp<sup>+</sup>+OH<sup>-</sup> | |||
pKa=9,很稳定,不像次氯酸一样,氧化性也很弱,人们完全不知道这是为什么。 | |||
在溶液里,H<sup>+</sup>和OH<sup>-</sup>共存,难免会中和: | |||
2WqOH⇌Wq<sub>2</sub>O+H<sub>2</sub>O | |||
所以次䃆酸只能在溶液中存在,蒸发溶液只能得到一氧化二䃆和其水合物。 | |||
一氧化二䃆溶于水也能得到次䃆酸。 | |||
次䃆酸即能和酸反应,也能和碱反应: | |||
WqOH+HCl→WqCl+H<sub>2</sub>O | |||
WqOH+NaOH→NaWqO+H<sub>2</sub>O | |||
如果酸过量,WqX(X=F,Cl,Br,I,At,Ts,Eg,Lru,Bin,Jw,Wm)会与HX反应,生成二X合次䃆酸,如: | |||
WqCl+HCl→HWqCl<sub>2</sub> | |||
WqBr+HBr→HWqBr<sub>2</sub> | |||
还有一种,WqX+HY(X,Y=F,Cl,Br,I,At,Ts,Eg,Lru,Bin,Jw,Wm)→HWqXY,如: | |||
WqF+HCl→HWqFCl | |||
WqJw+HLru→HWqLruJw | |||
== 䃆的+ | === 䃆的0价 === | ||
主要化合物 | [[File:ReWq.jpg|缩略图|䃆化铼]] | ||
[[File: | 化合物只有五种,分别是CoWq NiWq CuWq TcWq ReWq,其中最稳定的是ReWq。实际上金属带微量负电荷 | ||
==== 制备方法 ==== | |||
把Wq加热至400C,然后缓慢加入金属粉,加热114.514分钟,它会缓慢凝固。如果有没凝固的,那就是䃆,因为䃆的熔点是361C。倒掉就行了。 | |||
金属粉怎么去掉? | |||
很简单,只要把反应物磨成粉,加热至3500C,金属就要么熔化要么蒸发了。 | |||
CoWq是蓝色,NiWq是绿色,CuWq是红色,TcWq是黄绿色,ReWq是灰色。 | |||
=== 䃆的+2价 === | |||
[[File:一氧化䃆.jpg|缩略图|一氧化䃆]] | |||
主要化合物就一个一氧化䃆WqO,通过弱还原剂还原亚䃆酸盐得到。例如: | |||
Mg+Mg(WqO<sub>2</sub>)<sub>2</sub>→WqO+2MgO | |||
还原性一强,立刻变成䃆单质。 | |||
一氧化䃆比较稳定,无法与酸和碱反应,与氧化性物质反应生成亚䃆酸,如: | |||
2HNO<sub>3</sub>+2WqO—Δ→2NO<sub>2</sub>+2HWqO<sub>2</sub> | |||
与还原性物质反应生成䃆单质。 | |||
=== 䃆的+3价 === | |||
[[File:亚䃆酸钠.jpg|缩略图|亚䃆酸钠]] | |||
主要化合物就是亚䃆酸和亚䃆酸盐。 | |||
亚䃆酸可以参考亚氯酸,氧化性不强。 | |||
亚䃆酸盐的溶解度有点特殊,下面是一些溶解度: | |||
NaWqO<sub>2</sub> 0.032g/L | |||
KWqO<sub>2</sub> 0.013g/L | |||
NH<sub>4</sub>WqO<sub>2</sub> 0.021g/L | |||
LiWqO<sub>2</sub> 0.045g/L | |||
Ca(WqO<sub>2</sub>)<sub>2</sub> 0.014g/L | |||
=== 䃆的+4价 === | |||
==== 淇 ==== | |||
[[File:淇.jpg|缩略图|淇]] | |||
说到正四价卤素,大家肯定会想到二氧化物,䃆也是这样。 | |||
二氧化䃆是棕黑色液体,氧化性强,能氧化盐酸: | |||
2HCl+2WqO<sub>2</sub>→2HWqO<sub>2</sub>+Cl<sub>2</sub> | |||
因为二氧化䃆是液体,所以也叫淇。 | |||
==== 淇酸 ==== | |||
淇和水反应生成淇酸: | |||
H<sub>2</sub>O+WqO<sub>2</sub>→H<sub>2</sub>WqO<sub>3</sub> | |||
淇酸是超强酸,pKa=-10,常温下是黄色液体,可和水任意比例互溶。淇酸熔点-11.11C,沸点111.11C,和淇酸盐相比很高。 | |||
==== 淇酸盐 ==== | |||
所有淇酸盐都是液体。如淇酸钠,熔点-23.33C,沸点只有79.03C,在䃆星被称为“盐水” | |||
淇酸盐不溶于水,溶于淇酸,经过淇酸酸化后会形成酸式盐,其中Be<sub>2</sub>H<sub>2</sub>(WqO<sub>3</sub>)<sub>3</sub>·5H<sub>2</sub>O(五水合淇酸一氢铍)在䃆星和[[锑星]]被当作糖浆,pKa是-50,对[[碲球人]]有剧毒,禁止在碲球人饲料中添加五水合淇酸一氢铍。 | |||
=== 䃆的+5价 === | |||
== 䃆 | ==== 䃆酸 ==== | ||
䃆酸比其他卤素的+5价更稳定,因为䃆失去5个电子形成的是356号元素(11月21日还没命名)的结构 | |||
䃆酸也是超强酸,酸性达到了超盐酸级别,腐蚀性却很弱,以至于常温下和镁都反应不了,只有加热才反应。 | |||
[[File:五氧化二䃆和䃆酸䃆酰.jpg|缩略图]] | |||
==== 五氧化二䃆和䃆酸䃆酰 ==== | |||
另外两种:五氧化二䃆和䃆酸䃆酰。虽然化学式一样,但是一个是Wq<sub>2</sub>O<sub>5</sub>,另一个是WqO<sub>2</sub>WqO<sub>3</sub>,如图 | |||
===== 䃆酸䃆酰 ===== | |||
䃆酸䃆酰在水中释放出䃆酰阳离子(WqO<sub>2</sub><sup>+</sup>),能够形成䃆酰氟、䃆酰氯等一系列化合物。 | |||
如:WqO<sub>2</sub>WqO<sub>3</sub>+HF→HWqO<sub>3</sub>+WqO<sub>2</sub>F | |||
==参考资料== | |||
<references/> | |||
{{元素周期表简表}} | {{元素周期表简表}} | ||
[[category:超理元素]] | |||
2024年12月22日 (日) 05:20的最新版本
| 问题:本条目的内容或组织形式与百科词条相去甚远。 修改建议:请协助整理内容,并将不适合作为百科词条的内容移至超理文献、个人博客等名字空间下。 |
修改 · 讨论 · 规范 · 准则
䃆(Weiqine)是361号元素,符号Wq,电子排布式[Gh]7h228g189f1410d1011s211p5,单质是棕色固体。[1]䃆的电负性很低,所以表现得与金属类似,能与酸反应,且它的氢化物里氢带负电,所以制取䃆化物只能直接化合。䃆最常见的化合价就是-1价,化合物包括大多数金属䃆化物。
常见化合价下的性质[编辑]
䃆的+1价[编辑]

䃆的+1价主要化合物有WqX (X=F, Cl, Br, I, H, OH, NO3)、Wq2X (X=O, S, SO4)以及Wq3N和CWq4。
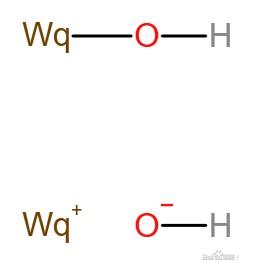
先介绍次䃆酸(WqOH,又称氢氧化䃆),结构Wq-O-H
次䃆酸是两性化合物,存在两种电离:
WqOH⇌WpO-+H+
WqOH⇌Wp++OH-
pKa=9,很稳定,不像次氯酸一样,氧化性也很弱,人们完全不知道这是为什么。
在溶液里,H+和OH-共存,难免会中和:
2WqOH⇌Wq2O+H2O
所以次䃆酸只能在溶液中存在,蒸发溶液只能得到一氧化二䃆和其水合物。
一氧化二䃆溶于水也能得到次䃆酸。
次䃆酸即能和酸反应,也能和碱反应:
WqOH+HCl→WqCl+H2O
WqOH+NaOH→NaWqO+H2O
如果酸过量,WqX(X=F,Cl,Br,I,At,Ts,Eg,Lru,Bin,Jw,Wm)会与HX反应,生成二X合次䃆酸,如:
WqCl+HCl→HWqCl2
WqBr+HBr→HWqBr2
还有一种,WqX+HY(X,Y=F,Cl,Br,I,At,Ts,Eg,Lru,Bin,Jw,Wm)→HWqXY,如:
WqF+HCl→HWqFCl
WqJw+HLru→HWqLruJw
䃆的0价[编辑]

化合物只有五种,分别是CoWq NiWq CuWq TcWq ReWq,其中最稳定的是ReWq。实际上金属带微量负电荷
制备方法[编辑]
把Wq加热至400C,然后缓慢加入金属粉,加热114.514分钟,它会缓慢凝固。如果有没凝固的,那就是䃆,因为䃆的熔点是361C。倒掉就行了。
金属粉怎么去掉?
很简单,只要把反应物磨成粉,加热至3500C,金属就要么熔化要么蒸发了。
CoWq是蓝色,NiWq是绿色,CuWq是红色,TcWq是黄绿色,ReWq是灰色。
䃆的+2价[编辑]

主要化合物就一个一氧化䃆WqO,通过弱还原剂还原亚䃆酸盐得到。例如:
Mg+Mg(WqO2)2→WqO+2MgO
还原性一强,立刻变成䃆单质。
一氧化䃆比较稳定,无法与酸和碱反应,与氧化性物质反应生成亚䃆酸,如:
2HNO3+2WqO—Δ→2NO2+2HWqO2
与还原性物质反应生成䃆单质。
䃆的+3价[编辑]

主要化合物就是亚䃆酸和亚䃆酸盐。
亚䃆酸可以参考亚氯酸,氧化性不强。
亚䃆酸盐的溶解度有点特殊,下面是一些溶解度:
NaWqO2 0.032g/L
KWqO2 0.013g/L
NH4WqO2 0.021g/L
LiWqO2 0.045g/L
Ca(WqO2)2 0.014g/L
䃆的+4价[编辑]
淇[编辑]

说到正四价卤素,大家肯定会想到二氧化物,䃆也是这样。
二氧化䃆是棕黑色液体,氧化性强,能氧化盐酸:
2HCl+2WqO2→2HWqO2+Cl2
因为二氧化䃆是液体,所以也叫淇。
淇酸[编辑]
淇和水反应生成淇酸:
H2O+WqO2→H2WqO3
淇酸是超强酸,pKa=-10,常温下是黄色液体,可和水任意比例互溶。淇酸熔点-11.11C,沸点111.11C,和淇酸盐相比很高。
淇酸盐[编辑]
所有淇酸盐都是液体。如淇酸钠,熔点-23.33C,沸点只有79.03C,在䃆星被称为“盐水”
淇酸盐不溶于水,溶于淇酸,经过淇酸酸化后会形成酸式盐,其中Be2H2(WqO3)3·5H2O(五水合淇酸一氢铍)在䃆星和锑星被当作糖浆,pKa是-50,对碲球人有剧毒,禁止在碲球人饲料中添加五水合淇酸一氢铍。
䃆的+5价[编辑]
䃆酸[编辑]
䃆酸比其他卤素的+5价更稳定,因为䃆失去5个电子形成的是356号元素(11月21日还没命名)的结构
䃆酸也是超强酸,酸性达到了超盐酸级别,腐蚀性却很弱,以至于常温下和镁都反应不了,只有加热才反应。
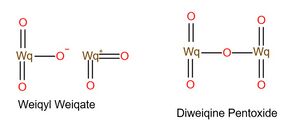
五氧化二䃆和䃆酸䃆酰[编辑]
另外两种:五氧化二䃆和䃆酸䃆酰。虽然化学式一样,但是一个是Wq2O5,另一个是WqO2WqO3,如图
䃆酸䃆酰[编辑]
䃆酸䃆酰在水中释放出䃆酰阳离子(WqO2+),能够形成䃆酰氟、䃆酰氯等一系列化合物。
如:WqO2WqO3+HF→HWqO3+WqO2F
参考资料[编辑]
| 元素周期表 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
<tabber>复数周期=
|