「二硫碘化钾」:修訂間差異
外觀
imported>Aaa762021 無編輯摘要 |
imported>黄金之风 無編輯摘要 |
||
| (未顯示由 1 位使用者於中間所作的 4 次修訂) | |||
| 第5行: | 第5行: | ||
==结构== | ==结构== | ||
KIS<sub>2</sub>存在两种同分异构体,为二硫代亚碘酸钾(KSIS)和二硫代过氧次碘酸钾(KSSI),结构如图。 | KIS<sub>2</sub>存在两种同分异构体,为二硫代亚碘酸钾(KSIS)和二硫代过氧次碘酸钾(KSSI),结构如图。 | ||
[[File: | [[File:KSSI.png|thumb|过硫次碘酸钾]] | ||
[[File: | [[File:KSIS.png|thumb|二硫代亚碘酸钾]] | ||
两种异构体中,一般认为碘都是+1价。这是因为锑场下硫的非金属性很强,在异构体KSSI中,I-S键中的电子偏向硫;而在异构体KSIS中,因为I-S配位键的存在,降低了碘上的电子密度,从而是I-S单键中的电子偏向碘。 | |||
==制取== | ==制取== | ||
| 第21行: | 第21行: | ||
将制取出的二硫碘化钾于-250℃的温度下冷却,并持续加强锑场与铌场,并加入ZMY催化剂,可以观察到如下反应: | 将制取出的二硫碘化钾于-250℃的温度下冷却,并持续加强锑场与铌场,并加入ZMY催化剂,可以观察到如下反应: | ||
KIS<sub>2</sub>=低温=KIS+S | |||
KIS+S=zmy=KSSI | |||
==用途== | ==用途== | ||
在锑星化工业中,二硫碘化钾常被作为生产[[砹氰]]的催化剂。 | 在锑星化工业中,二硫碘化钾常被作为生产[[砹氰]]的催化剂。 | ||
| 第29行: | 第29行: | ||
同时,二硫碘化钾也被用作氰人节、七-{A|矽; zh-hans:矽; zh-hant:矽; zh-cn:矽; zh:矽;}-节等节日时,装饰物及礼物的原材料。 | 同时,二硫碘化钾也被用作氰人节、七-{A|矽; zh-hans:矽; zh-hant:矽; zh-cn:矽; zh:矽;}-节等节日时,装饰物及礼物的原材料。 | ||
== | == 合成过硫次碘酸钾'''实验报告''' == | ||
* | |||
=== 实验步骤 === | |||
* 在13~14℃下,准备苛性氢和氢氧酸各100mL,称取14.24g(0.1mol)二硫化钾和25.38g(0.1mol)碘单质备用。 | |||
* 将二硫化钾和碘单质分别用苛性氢和氢氧酸配成浓度1mol/L的溶液。 | |||
* 将二硫化钾的苛性氢溶液倒入'''铯质烧杯'''中,往其中丢入一小块'''锑质搅拌子''',打开锑场搅拌器,进行充分搅拌。 | |||
* 将碘的氢氧酸溶液缓慢滴入烧杯中,控制反应速率为520滴/分。溶液完全变为无色即可停止。 | |||
* 反应完毕后,加入萃取剂,振荡,用分液漏斗分出萃取剂。 | |||
* 减压蒸馏除去萃取剂,得到纯度很高的过硫次碘酸钾,称重计算产率,理论产量为23.01g。 | |||
实验原理 | |||
K<sub>2</sub>S<sub>2</sub>+I<sub>2</sub>=KISS+KI | |||
注意事项 | |||
# 二硫化钾对酸不稳定,需要用苛性氢溶解;碘单质对碱不稳定,需要用氢氧酸溶解。 | |||
# 二硫化钾溶液呈微黄色至金黄色,碘溶液呈淡紫色至紫黑色,而过硫次碘酸钾的溶液为无色。可以观察溶液颜色而确认反应是否充分。 | |||
# 滴入太快或太慢都会发生副反应。 | |||
# 在反应终点,苛性氢和氢氧酸完全中和,溶液呈中性。 | |||
[[Category:无机化合物]] | [[Category:无机化合物]] | ||
於 2025年3月22日 (六) 06:58 的最新修訂
二硫碘化鉀(KIS2)是一種超理物質。有二硫代亞碘酸鉀(KSIS)和過硫次碘酸鉀(KSSI)兩種同分異構體。
結構[編輯]
KIS2存在兩種同分異構體,為二硫代亞碘酸鉀(KSIS)和二硫代過氧次碘酸鉀(KSSI),結構如圖。
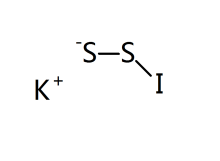
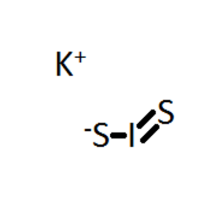
兩種異構體中,一般認為碘都是+1價。這是因為銻場下硫的非金屬性很強,在異構體KSSI中,I-S鍵中的電子偏向硫;而在異構體KSIS中,因為I-S配位鍵的存在,降低了碘上的電子密度,從而是I-S單鍵中的電子偏向碘。
製取[編輯]
二硫碘化鉀/二硫代亞碘酸鉀[編輯]
第一步:用鉀與亞碘酸製取KIO2。
2HIO2+2K==2KIO2+H2↑
第二步:在銻場或鉍場以及ZMY催化劑的催化下製取KIS2。
KIO2+2S=zmy=KIS2+O2↑
二硫代過氧次碘酸鉀[編輯]
將製取出的二硫碘化鉀於-250℃的溫度下冷卻,並持續加強銻場與鈮場,並加入ZMY催化劑,可以觀察到如下反應:
KIS2=低溫=KIS+S
KIS+S=zmy=KSSI
用途[編輯]
在銻星化工業中,二硫碘化鉀常被作為生產砹氰的催化劑。
同時,二硫碘化鉀也被用作氰人節、七矽節等節日時,裝飾物及禮物的原材料。
合成過硫次碘酸鉀實驗報告[編輯]
實驗步驟[編輯]
- 在13~14℃下,準備苛性氫和氫氧酸各100mL,稱取14.24g(0.1mol)二硫化鉀和25.38g(0.1mol)碘單質備用。
- 將二硫化鉀和碘單質分別用苛性氫和氫氧酸配成濃度1mol/L的溶液。
- 將二硫化鉀的苛性氫溶液倒入銫質燒杯中,往其中丟入一小塊銻質攪拌子,打開銻場攪拌器,進行充分攪拌。
- 將碘的氫氧酸溶液緩慢滴入燒杯中,控制反應速率為520滴/分。溶液完全變為無色即可停止。
- 反應完畢後,加入萃取劑,振盪,用分液漏斗分出萃取劑。
- 減壓蒸餾除去萃取劑,得到純度很高的過硫次碘酸鉀,稱重計算產率,理論產量為23.01g。
實驗原理
K2S2+I2=KISS+KI
注意事項
- 二硫化鉀對酸不穩定,需要用苛性氫溶解;碘單質對鹼不穩定,需要用氫氧酸溶解。
- 二硫化鉀溶液呈微黃色至金黃色,碘溶液呈淡紫色至紫黑色,而過硫次碘酸鉀的溶液為無色。可以觀察溶液顏色而確認反應是否充分。
- 滴入太快或太慢都會發生副反應。
- 在反應終點,苛性氫和氫氧酸完全中和,溶液呈中性。