季戊四酸:修订间差异
imported>数理考高分 添加分类 |
imported>Wenglizi 无编辑摘要 |
||
| (未显示3个用户的17个中间版本) | |||
| 第1行: | 第1行: | ||
{{ | {{半管制品}} | ||
246.1263 g/mol(三水合物)|外观=无色晶体|气味=极度浓烈的刺激性的气味,类似于加强版冰醋酸|熔点=78°C|沸点=181.2°C(分解)|pka=0.43(1) | {{化合物性质模版|image1=季戊四酸2.jpg.png|image2=季戊四酸.jpg|caption2=三水合季戊四酸晶体|别名=季戊四醇酸,四羧基甲烷|化学式=C<sub>5</sub>O<sub>8</sub>H<sub>4</sub>|摩尔质量=192.0805 g/mol(无水) | ||
246.1263 g/mol(三水合物)|外观=无色晶体|气味=极度浓烈的刺激性的气味,类似于加强版冰醋酸|熔点=78°C|沸点=181.2°C(完全分解)|pka=0.43(1) | |||
2.42(2) | 2.42(2) | ||
4.7(3) | 4.7(3) | ||
| 第6行: | 第7行: | ||
刺激性(Xi)|其他阳离子=季戊四酸盐|其他阴离子=丙二酸,乙酸}} | 刺激性(Xi)|其他阳离子=季戊四酸盐|其他阴离子=丙二酸,乙酸}} | ||
'''季戊四酸'''(鹰语 | '''季戊四酸'''(鹰语: Methanetetracarboxylic acid,简称:MTTBA)是一种有机强酸,化学式为C(COOH)<sub>4</sub>或H<sub>4</sub>PTRA,又称三羧基乙酸,四羧基碳,四羧基甲烷,季戊四醇酸,在地球上,这是一种很不稳定的物质,常温下会剧烈的脱羧,但是在[[锑场]]的作用下,这种物质在60°C以上时才会缓慢脱羧,其脱羧产物包含了甲烷,乙酸,丙二酸和二氧化碳。具有腐蚀性,其酸性略弱于三氟乙酸,属于比碘酸和三氯乙酸强的强酸,也是很常用的化工原料。 | ||
季戊四酸由于具有很强的腐蚀性和刺激性,故它在锑宙多个星球已经被列为了半管制品,受到了中等强度的管控,但其3%水溶液常用于治疗体表真菌感染,因腐蚀性较低而不受任何管控。 | |||
[[碲球人]]尚未制得,但己制得其盐和酯。 | |||
== 历史 == | |||
季戊四酸最早由古[[氮星]]人于公元前4000年从矿物与硫酸氢钠混合蒸馏中分离出来,那时候锑宙的科技水平才相当于地球上的唐朝前期,但是已经出现了玻璃仪器和三酸,氮星人当时称其为“镪醋“,意思是“具有强烈腐蚀性的白醋类似物”,目前发现的氮星对于季戊四酸最早的描述文献是《膏烷经》,它描述季戊四酸的片段被收藏在氮星国家博物馆中,其原文如下: | |||
{| | |||
!《膏烷经》涩水<ref>涩水在古代氮星中指代具有强烈酸性的近无色或无色物质</ref>卷原文: | |||
|- | |||
|取镪芒<sup>[1]</sup>三两,玢<sup>[2]</sup>戊<sup>[3]</sup>两,置鼎<sup>[4]</sup>中,就鼎下生火,以竹筒入鼎口,取杯置竹筒末,及鼎中石皆消之,杯有白醋如物,是镪醋也。 | |||
镪醋者,味甚涩,乃其溴过<sup>[5]</sup>,能令人泪潸流涕<sup>[6]</sup>,不可近也,强烧则消残而尽,不复返焉。 | |||
|- | |||
|注释:<small>[1]镪芒:指硫酸氢钠。 [2]玢:锑酸铜矿,氮星上此矿含有少量季戊四酸二氢铜杂质,故可以用来制造季戊四酸。[3]戊:五 [4]鼎:这里是对所有烧瓶的统称,氮星古代无各种烧瓶之分。 [5]此部分只有一个字,在出土前就被破坏,故已不可考,溴,通“嗅”,气味 [6]流涕:这里指令人鼻子不舒服</small> | |||
|} | |||
2001年,人们又发现了[[氟星]]出土的公元前3300年的古书籍《弗药记》中也有又关于类似于季戊四酸物质的纪录,但无法确认它是不是季戊四酸。 | |||
120年,季戊四酸已经实现了量化生产,当时人们采用水解四氰化碳的方式制造该物质,但因为四氰化碳强大的毒性,目前此方法仅在[[砷星]]和[[氰星]]被采用。2008年,根据[[锑际卫生组织]]的禁用食品添加剂名录,季戊四酸因为“具有潜在致癌性”而被列入禁用食品添加剂名单,但其酸式盐仍然允许被使用,在此之前它主要作为酸味剂使用。 | |||
== 性质 == | |||
=== 电离与酸性 === | |||
羧基是一种很强的拉电子基团,根据诱导效应,季戊四酸是一种强酸,其在水中电离分为四步:<blockquote>C<sub>5</sub>O<sub>8</sub>H<sub>4</sub> → C<sub>5</sub>O<sub>8</sub>H<sub>3</sub><sup>-</sup> + H<sup>+</sup> '''pKa=0.43'''</blockquote><blockquote>C<sub>5</sub>O<sub>8</sub>H<sub>3</sub><sup>-</sup> ⇌ C<sub>5</sub>O<sub>8</sub>H<sub>2</sub><sup>2-</sup> + H<sup>+</sup> '''pKa=2.42'''</blockquote><blockquote>C<sub>5</sub>O<sub>8</sub>H<sub>2</sub><sup>2-</sup> ⇌ C<sub>5</sub>O<sub>8</sub>H<sup>3-</sup> + H<sup>+</sup> '''pKa=4.7'''</blockquote><blockquote>C<sub>5</sub>O<sub>8</sub>H<sup>3-</sup> ⇌ C<sub>5</sub>O<sub>8</sub><sup>4-</sup> + H<sup>+</sup> '''pKa=7.9'''</blockquote>其中第一步电离已经可以达到强酸水平,而后三步电离程度甚少,所以季戊四酸四钠的水溶液是强碱性的,其饱和水溶液,而如果在季戊四酸四钠的乙醚溶液中加入氨基屎,那它还可以给出一个羧基,变成一个C(COO)<sub>3</sub><sup>5-</sup>碳负离子,这个碳负离子在水中碱性甚至超过了氢氧化铯,会直接剧烈地水解为叔丁三酸根,一般的碱无法做到将季戊四酸上的一个羧基脱下,同时氨基屎被变成了羧基合氨基屎阳离子,目前,超理学家发现了[[浓硫碱]]和甲基氛的混合物可以可逆的脱下季戊四酸第二个羧基合第三个羧基,过量的金属铯也有可能会将季戊四酸变成裸露的C<sup>4-</sup>。 | |||
=== 碱性 === | |||
目前还未发现有季戊四酸作为质子碱的化合物,哪怕是氟氦化氢也难以质子化该酸,其原因之一是在于四个羧基加大了位阻,使得中心的碳原子极为惰性。 | |||
=== 有机合成 === | |||
季戊四酸和一般的有机酸一样,可以进行多数有机反应,与一般的酸不同的是,它在酰化反应上更为活泼,可作为一种酰化试剂使用。 | |||
在被氢化还原时,季戊四酸有两种还原途径,一种是脱去羧基,并形成甲烷和甲酸,甲酸继续被还原为甲醇,另外一种则是直接形成季戊四醇,两种反应同时进行,为使用季戊四酸制备季戊四醇带来很大的麻烦。 | |||
季戊四酸通过五溴化磷溴化成季戊四酰溴,再通过以下途径可以制备鱼形胺(第二步反应中再次加入水是为了大量水解掉副产物) | |||
[[File:季戊四酸合成鱼形胺.png|居中|无框|580x580像素]] | |||
=== 盐类 === | |||
季戊四酸作为一种四元酸,具备许多不同的酸根阴离子,包括了季戊四酸三氢根,季戊四酸二氢根,季戊四酸氢根和季戊四酸根,其中以季戊四酸三氢盐和季戊四酸盐最为常见,在pH=10.5的溶液中,季戊四酸盐主要以季戊四酸根和季戊四酸氢根的形式存在,也具有微量的季戊四酸二氢根,但季戊四酸三氢根和季戊四酸几乎不存在,在pH=7.0左右时,季戊四酸盐主要以季戊四酸勤奋根和季戊四酸一氢根的形式存在,pH=1.0时,此时溶液中存在大量的季戊四酸三氢根和少量的季戊四酸,可见其盐存在形式类似于磷酸盐,但是其正盐碱性更弱。 | |||
季戊四酸盐和季戊四酸一氢盐几乎全部都是难溶于水的,而季戊四酸二氢盐溶解性也不强,但是季戊四酸三氢盐在水中几乎都是易溶于水的,下列是一些有关于季戊四酸盐溶解性的表格: | |||
{| class="fandom-table" | |||
! | |||
!PTRA<sup>4-</sup> | |||
!HPTRA<sup>3-</sup> | |||
!H<sub>2</sub>PTRA<sup>2-</sup> | |||
!H<sub>3</sub>PTRA<sup>-</sup> | |||
|- | |||
|Na<sup>+</sup> | |||
| colspan="4" rowspan="2" |易溶 | |||
|- | |||
|NH<sub>4</sub><sup>+</sup> | |||
|- | |||
|K<sup>+</sup> | |||
|易溶 | |||
| colspan="3" |可溶 | |||
|- | |||
|Cs<sup>+</sup> | |||
| colspan="3" |易溶 | |||
|略溶 | |||
|- | |||
|Mg<sup>2+</sup> | |||
|难溶 | |||
|难溶 | |||
|微溶 | |||
|易溶 | |||
|- | |||
|Ca<sup>2+</sup> | |||
|难溶 | |||
|难溶 | |||
|微溶 | |||
|易溶 | |||
|- | |||
|Ba<sup>2+</sup> | |||
|难溶 | |||
|难溶 | |||
(微溶于沸水) | |||
|微溶 | |||
|易溶 | |||
|- | |||
|Al<sup>3+</sup> | |||
| colspan="3" |双水解 | |||
|易溶 | |||
|- | |||
|Ga<sup>3+</sup> | |||
| colspan="2" |双水解 | |||
|可溶 | |||
|易溶 | |||
|- | |||
|Sn<sup>2+</sup> | |||
|难溶 | |||
|难溶 | |||
|微溶 | |||
|可溶 | |||
|- | |||
|Sn<sup>4+</sup> | |||
| colspan="2" |双水解 | |||
|不存在 | |||
|分解 | |||
|- | |||
|Pb<sup>2+</sup> | |||
|极难溶 | |||
|难溶 | |||
|难溶 | |||
|略溶 | |||
(溶于沸水) | |||
|- | |||
|Sb<sup>3+</sup> | |||
| colspan="3" rowspan="2" |双水解 | |||
|水解 | |||
|- | |||
|Bi<sup>3+</sup> | |||
|可溶 | |||
|} | |||
季戊四酸四钠的氢氧化钠溶液在[[碲球]]上是稳定的,碲球人也已制得。 | |||
== 用途 == | |||
主要用于治疗体表真菌感染,或作为络合剂使用,也是生产镇暴化学武器季戊四酰氯的前体,常见于医药和电镀。{{酸}} | |||
[[Category:有机化合物]] | [[Category:有机化合物]] | ||
[[Category:酸]] | [[Category:酸]] | ||
2022年11月2日 (三) 08:01的最新版本
季戊四酸(鹰语: Methanetetracarboxylic acid,简称:MTTBA)是一种有机强酸,化学式为C(COOH)4或H4PTRA,又称三羧基乙酸,四羧基碳,四羧基甲烷,季戊四醇酸,在地球上,这是一种很不稳定的物质,常温下会剧烈的脱羧,但是在锑场的作用下,这种物质在60°C以上时才会缓慢脱羧,其脱羧产物包含了甲烷,乙酸,丙二酸和二氧化碳。具有腐蚀性,其酸性略弱于三氟乙酸,属于比碘酸和三氯乙酸强的强酸,也是很常用的化工原料。
季戊四酸由于具有很强的腐蚀性和刺激性,故它在锑宙多个星球已经被列为了半管制品,受到了中等强度的管控,但其3%水溶液常用于治疗体表真菌感染,因腐蚀性较低而不受任何管控。
碲球人尚未制得,但己制得其盐和酯。
历史[编辑]
季戊四酸最早由古氮星人于公元前4000年从矿物与硫酸氢钠混合蒸馏中分离出来,那时候锑宙的科技水平才相当于地球上的唐朝前期,但是已经出现了玻璃仪器和三酸,氮星人当时称其为“镪醋“,意思是“具有强烈腐蚀性的白醋类似物”,目前发现的氮星对于季戊四酸最早的描述文献是《膏烷经》,它描述季戊四酸的片段被收藏在氮星国家博物馆中,其原文如下:
| 《膏烷经》涩水[1]卷原文: |
|---|
| 取镪芒[1]三两,玢[2]戊[3]两,置鼎[4]中,就鼎下生火,以竹筒入鼎口,取杯置竹筒末,及鼎中石皆消之,杯有白醋如物,是镪醋也。
镪醋者,味甚涩,乃其溴过[5],能令人泪潸流涕[6],不可近也,强烧则消残而尽,不复返焉。 |
| 注释:[1]镪芒:指硫酸氢钠。 [2]玢:锑酸铜矿,氮星上此矿含有少量季戊四酸二氢铜杂质,故可以用来制造季戊四酸。[3]戊:五 [4]鼎:这里是对所有烧瓶的统称,氮星古代无各种烧瓶之分。 [5]此部分只有一个字,在出土前就被破坏,故已不可考,溴,通“嗅”,气味 [6]流涕:这里指令人鼻子不舒服 |
2001年,人们又发现了氟星出土的公元前3300年的古书籍《弗药记》中也有又关于类似于季戊四酸物质的纪录,但无法确认它是不是季戊四酸。
120年,季戊四酸已经实现了量化生产,当时人们采用水解四氰化碳的方式制造该物质,但因为四氰化碳强大的毒性,目前此方法仅在砷星和氰星被采用。2008年,根据锑际卫生组织的禁用食品添加剂名录,季戊四酸因为“具有潜在致癌性”而被列入禁用食品添加剂名单,但其酸式盐仍然允许被使用,在此之前它主要作为酸味剂使用。
性质[编辑]
电离与酸性[编辑]
羧基是一种很强的拉电子基团,根据诱导效应,季戊四酸是一种强酸,其在水中电离分为四步:
C5O8H4 → C5O8H3- + H+ pKa=0.43
C5O8H3- ⇌ C5O8H22- + H+ pKa=2.42
C5O8H22- ⇌ C5O8H3- + H+ pKa=4.7
C5O8H3- ⇌ C5O84- + H+ pKa=7.9
其中第一步电离已经可以达到强酸水平,而后三步电离程度甚少,所以季戊四酸四钠的水溶液是强碱性的,其饱和水溶液,而如果在季戊四酸四钠的乙醚溶液中加入氨基屎,那它还可以给出一个羧基,变成一个C(COO)35-碳负离子,这个碳负离子在水中碱性甚至超过了氢氧化铯,会直接剧烈地水解为叔丁三酸根,一般的碱无法做到将季戊四酸上的一个羧基脱下,同时氨基屎被变成了羧基合氨基屎阳离子,目前,超理学家发现了浓硫碱和甲基氛的混合物可以可逆的脱下季戊四酸第二个羧基合第三个羧基,过量的金属铯也有可能会将季戊四酸变成裸露的C4-。
碱性[编辑]
目前还未发现有季戊四酸作为质子碱的化合物,哪怕是氟氦化氢也难以质子化该酸,其原因之一是在于四个羧基加大了位阻,使得中心的碳原子极为惰性。
有机合成[编辑]
季戊四酸和一般的有机酸一样,可以进行多数有机反应,与一般的酸不同的是,它在酰化反应上更为活泼,可作为一种酰化试剂使用。
在被氢化还原时,季戊四酸有两种还原途径,一种是脱去羧基,并形成甲烷和甲酸,甲酸继续被还原为甲醇,另外一种则是直接形成季戊四醇,两种反应同时进行,为使用季戊四酸制备季戊四醇带来很大的麻烦。
季戊四酸通过五溴化磷溴化成季戊四酰溴,再通过以下途径可以制备鱼形胺(第二步反应中再次加入水是为了大量水解掉副产物)
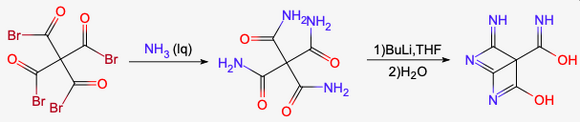
盐类[编辑]
季戊四酸作为一种四元酸,具备许多不同的酸根阴离子,包括了季戊四酸三氢根,季戊四酸二氢根,季戊四酸氢根和季戊四酸根,其中以季戊四酸三氢盐和季戊四酸盐最为常见,在pH=10.5的溶液中,季戊四酸盐主要以季戊四酸根和季戊四酸氢根的形式存在,也具有微量的季戊四酸二氢根,但季戊四酸三氢根和季戊四酸几乎不存在,在pH=7.0左右时,季戊四酸盐主要以季戊四酸勤奋根和季戊四酸一氢根的形式存在,pH=1.0时,此时溶液中存在大量的季戊四酸三氢根和少量的季戊四酸,可见其盐存在形式类似于磷酸盐,但是其正盐碱性更弱。
季戊四酸盐和季戊四酸一氢盐几乎全部都是难溶于水的,而季戊四酸二氢盐溶解性也不强,但是季戊四酸三氢盐在水中几乎都是易溶于水的,下列是一些有关于季戊四酸盐溶解性的表格:
| PTRA4- | HPTRA3- | H2PTRA2- | H3PTRA- | |
|---|---|---|---|---|
| Na+ | 易溶 | |||
| NH4+ | ||||
| K+ | 易溶 | 可溶 | ||
| Cs+ | 易溶 | 略溶 | ||
| Mg2+ | 难溶 | 难溶 | 微溶 | 易溶 |
| Ca2+ | 难溶 | 难溶 | 微溶 | 易溶 |
| Ba2+ | 难溶 | 难溶
(微溶于沸水) |
微溶 | 易溶 |
| Al3+ | 双水解 | 易溶 | ||
| Ga3+ | 双水解 | 可溶 | 易溶 | |
| Sn2+ | 难溶 | 难溶 | 微溶 | 可溶 |
| Sn4+ | 双水解 | 不存在 | 分解 | |
| Pb2+ | 极难溶 | 难溶 | 难溶 | 略溶
(溶于沸水) |
| Sb3+ | 双水解 | 水解 | ||
| Bi3+ | 可溶 | |||
季戊四酸四钠的氢氧化钠溶液在碲球上是稳定的,碲球人也已制得。
用途[编辑]
主要用于治疗体表真菌感染,或作为络合剂使用,也是生产镇暴化学武器季戊四酰氯的前体,常见于医药和电镀。
| 酸 | |
|---|---|
| 超盐酸 · 异超盐酸 · 半盐酸 · 硫硼酸 · 亚盐酸 · 亚碳酸 · 镭酸 · 氢铂酸 · 氢金酸 · 高氟酸 · 高酸 · 超氢金酸 · 氢汞酸 · 超氢汞酸 · 一水合十九二氧化硅 · 发烟碳酸 · 氦酸 · 铵酸 · 氧酸 · 焦氧酸 · 硼烷酸 · 氢氩酸 · 超硝酸 · 甲烷酸 · 二氟化铯 · 一卤科化水科 · 膦酸 · 次屎酸 · 亚屎酸 · 金酸 · 正屎酸 · 卤锑酸 · 氢氢酸 · 亚氯酸 · 氢氰酸 · 氢硫酸 · 水酸 · 氨酸 · 乙二酸 · 草酸 · 季戊四酸 · 氟铀碳化氢 · 高氰酸 · 高硝酸 · 高碳酸 · 氢酸· 酸 |
- ↑ 涩水在古代氮星中指代具有强烈酸性的近无色或无色物质