氢金酸:修订间差异
imported>氢氰酸 无编辑摘要 |
imported>Hydrogen Sulfide |
||
| (未显示8个用户的26个中间版本) | |||
| 第1行: | 第1行: | ||
{{这不是真相}}{{化合物性质模版|title1=金化氢|image1=氢金酸填充模型.jpeg|image2=氢金酸液体.png|别名=氢金酸、氢化金|化学式=HAu|外观=无色气体,水溶液在强锑场下呈黄色|气味=特殊的刺激性恶臭|密度=3.3g/cm³|熔点=-13°C|沸点=-1.2°C|pka=-11.2|溶解性(水)=易溶于水|溶解性(其他溶剂)=可溶于苯等其它有机溶剂|偶极矩=0.1D(250zmy)|分子结构=直线型|锑宙联盟分类=腐蚀性(C) | |||
金化氢 | 剧毒(T+)|其他阳离子=金化铯、金化铷、金化四甲基铵|其他阴离子=氯化氢、氟化氢、溴化氢、碘化氢、砹化氢|相关化学品=[[铂化氢]]}} | ||
'''金化氢'''是一种无机化合物,化学式{{Chem|HAu}},水溶液称为氢金酸。常温下为无色气体,极易溶于[[一氧化二氢|水]],其水溶液在常规锑场下为无色液体,但是在强锑场作用下,氢离子对金离子极化作用增强,令水溶液表现为金黄色。具有挥发性,类似氯化氢。 | |||
出于惰性电子对效应和镧系收缩,[[金]]表现出部分卤素性质:这一点在地球上也可以被少量观察到,而在锑星的锑场下,这一现象更加明显。金的鲍林标度(2.54)比氢的电负性(2.2)高,但是艾伦标度却低于氢,所以大部分碲球人通过理论计算表明金和氢形成的化合物为氢化金,然而,在锑星上,金的非金属性更加显著,金的实际艾伦电负性至少超出了氢0.07左右,所以金和氢所形成的化合物就是金化氢。 | |||
==化学性质== | |||
可燃,在[[氧|氧气]]中燃烧生成金粉末和[[一氧化二氢|水]]<ref>三氧化二金受热极易分解,并且氧气的氧化性不足以直接将金氧化至+3价</ref>:4HAu+O<sub>2</sub>=点燃=2H<sub>2</sub>O+4Au。 | |||
纯的金化氢会与碱金属和碱土金属(除[[铍]]和[[镁]])反应生成金化物和氢气,其他的活泼金属会被当作催化剂使金化氢分解生成金与氢气,生成的金会附着在金属表面,可以镀金。 | 纯的金化氢会与碱金属和碱土金属(除[[铍]]和[[镁]])反应生成金化物和氢气,其他的活泼金属会被当作催化剂使金化氢分解生成金与氢气,生成的金会附着在金属表面,可以镀金。 | ||
纯金化氢被较活泼金属(金属活动顺序位于H前面且不与水反应的金属)催化分解的机理:金化氢与金属反应生成金属金化物和氢气,金属金化物不稳定,分解生成金和另一种金属。于是生成的金附着在金属表面,使金属镀金并钝化。如果是氢金酸的稀溶液则会将金属腐蚀。 | 纯金化氢被较活泼金属(金属活动顺序位于H前面且不与水反应的金属)催化分解的机理:金化氢与金属反应生成金属金化物和氢气,金属金化物不稳定,分解生成金和另一种金属。于是生成的金附着在金属表面,使金属镀金并钝化。如果是氢金酸的稀溶液则会将金属腐蚀。 | ||
如果溶液中氢离子超过一定浓度, | 如果溶液中金属离子(能与水反应的金属的离子如{{Chem|K+}},{{Chem|Ca^2+}},{{Chem|Na+}}等除外)浓度过大,氢金酸就能将金属离子还原为金属单质沉淀出来,自身被氧化为单质[[金]],但在Au<sup>-</sup>浓度较低的情况下只能得到低价金属。如[[氯化铁]]与氢金酸反应生成氯化亚铁、金和[[盐酸]]。 | ||
[[Category:超理 | |||
亚硝酸盐在金化氢作用下会被还原为肼,红硒与氢金酸反应得到硒化氢,与含有羰基配体稳定的部分金属反应(如铁),也可以将其还原为负价羰基金属离子,如果溶液中氢离子超过一定浓度,金负离子也能将氢离子还原,此时的结果相当于金化氢分解。 | |||
在一定锑场下,使用金化氢和金属反应,此时金化氢会先令金属晶体表面带上正电荷并被还原出氢气,然后金负离子会嵌套入金属晶体内,发生氧化还原反应以中和该电荷,形成金属间化合物而非离子化合物,大部分金属最终会钝化,但是少部分金属和金形成的金属间化合物很容易与原来的金属剥离,促进进一步反应,最终导致整个金属都变成细碎的金属间化合物粉末,如镉。在这些化合物当中,金被观察到带有少量负电性。 | |||
同样的,金负离子虽然和卤素负离子性质十分接近,但也不完全相同,氢金酸也可以和一些电中性配体在锑场下反应,形成比金负离子更稳定的类似于拟卤素的负离子,在这些负离子当中,金依然可以看作-1价,例如一氧化碳在强锑场作用下与氢金酸反应,形成多种羰基金酸,这些羰基金酸多为浅黄色油状液体,在强锑场作用下,6p轨道的分裂更为显著,其中6p1/2轨道的能量降低也会更为明显,表现出与6s轨道靠拢之势,让金可以依靠将额外电子激发到6p1/2轨道上来容纳其它电子,形成相对稳定结构,并表现出少量拟氮族元素的性质,在3191039zmy下,AuH<sub>3</sub>作为主要的氢金化物存在。 | |||
而在强金场作用下,金的非金属性进一步增强,此时的氢金酸性质与氢碘酸十分接近,金负离子受到阳离子相互作用减弱,浓氢金酸可以和Cu反应形成H[CuAu<sub>2</sub>],而[[金#脆性金|脆性金]](Au<sub>2</sub>)在此条件下也可以稳定存在。 | |||
碲球人已合成含Au<sup>-</sup>离子的{{LW|金化铯}}、{{LW|四甲基金化铵}}和{{LW|四金化硅}}等氢金酸盐。 | |||
=== 有机化学 === | |||
HAu可以作为一种强酸性还原剂被使用,以下展示了一条使用微量氢金酸来还原环己酮肟的实例: | |||
[[File:HAu反应.png|left|frameless|360x360px]] | |||
{{Clear}} | |||
如果氢金酸过量,那么图中的产物将会被还原为亚胺和自由基,进而形成胺类物质。 | |||
氢金酸和羟胺反应,可以把羟胺还原成肼。 | |||
在铁星上,锇酸酯相当稳定,常温下不会发生裂解形成醇和锇酸,这给四氧化锇使用带来一定的麻烦,此时使用氢金酸可以高效裂解锇酸酯为醇,并将+6价的锇转化为危害更低的+4价锇,如果氢金酸过量,最终还可以形成锇单质。 | |||
== 注释 == | |||
<references /> | |||
{{酸}} | |||
[[Category:超理物质]] | |||
[[Category:无机化合物]] | [[Category:无机化合物]] | ||
[[Category:超强酸]] | |||
[[Category:酸]] | |||
2024年8月6日 (二) 08:34的最新版本
金化氢是一种无机化合物,化学式HAu,水溶液称为氢金酸。常温下为无色气体,极易溶于水,其水溶液在常规锑场下为无色液体,但是在强锑场作用下,氢离子对金离子极化作用增强,令水溶液表现为金黄色。具有挥发性,类似氯化氢。
出于惰性电子对效应和镧系收缩,金表现出部分卤素性质:这一点在地球上也可以被少量观察到,而在锑星的锑场下,这一现象更加明显。金的鲍林标度(2.54)比氢的电负性(2.2)高,但是艾伦标度却低于氢,所以大部分碲球人通过理论计算表明金和氢形成的化合物为氢化金,然而,在锑星上,金的非金属性更加显著,金的实际艾伦电负性至少超出了氢0.07左右,所以金和氢所形成的化合物就是金化氢。
化学性质[编辑]
可燃,在氧气中燃烧生成金粉末和水[1]:4HAu+O2=点燃=2H2O+4Au。
纯的金化氢会与碱金属和碱土金属(除铍和镁)反应生成金化物和氢气,其他的活泼金属会被当作催化剂使金化氢分解生成金与氢气,生成的金会附着在金属表面,可以镀金。
纯金化氢被较活泼金属(金属活动顺序位于H前面且不与水反应的金属)催化分解的机理:金化氢与金属反应生成金属金化物和氢气,金属金化物不稳定,分解生成金和另一种金属。于是生成的金附着在金属表面,使金属镀金并钝化。如果是氢金酸的稀溶液则会将金属腐蚀。
如果溶液中金属离子(能与水反应的金属的离子如K+,Ca2+,Na+等除外)浓度过大,氢金酸就能将金属离子还原为金属单质沉淀出来,自身被氧化为单质金,但在Au-浓度较低的情况下只能得到低价金属。如氯化铁与氢金酸反应生成氯化亚铁、金和盐酸。
亚硝酸盐在金化氢作用下会被还原为肼,红硒与氢金酸反应得到硒化氢,与含有羰基配体稳定的部分金属反应(如铁),也可以将其还原为负价羰基金属离子,如果溶液中氢离子超过一定浓度,金负离子也能将氢离子还原,此时的结果相当于金化氢分解。
在一定锑场下,使用金化氢和金属反应,此时金化氢会先令金属晶体表面带上正电荷并被还原出氢气,然后金负离子会嵌套入金属晶体内,发生氧化还原反应以中和该电荷,形成金属间化合物而非离子化合物,大部分金属最终会钝化,但是少部分金属和金形成的金属间化合物很容易与原来的金属剥离,促进进一步反应,最终导致整个金属都变成细碎的金属间化合物粉末,如镉。在这些化合物当中,金被观察到带有少量负电性。
同样的,金负离子虽然和卤素负离子性质十分接近,但也不完全相同,氢金酸也可以和一些电中性配体在锑场下反应,形成比金负离子更稳定的类似于拟卤素的负离子,在这些负离子当中,金依然可以看作-1价,例如一氧化碳在强锑场作用下与氢金酸反应,形成多种羰基金酸,这些羰基金酸多为浅黄色油状液体,在强锑场作用下,6p轨道的分裂更为显著,其中6p1/2轨道的能量降低也会更为明显,表现出与6s轨道靠拢之势,让金可以依靠将额外电子激发到6p1/2轨道上来容纳其它电子,形成相对稳定结构,并表现出少量拟氮族元素的性质,在3191039zmy下,AuH3作为主要的氢金化物存在。
而在强金场作用下,金的非金属性进一步增强,此时的氢金酸性质与氢碘酸十分接近,金负离子受到阳离子相互作用减弱,浓氢金酸可以和Cu反应形成H[CuAu2],而脆性金(Au2)在此条件下也可以稳定存在。
碲球人已合成含Au-离子的金化铯、四甲基金化铵和四金化硅等氢金酸盐。
有机化学[编辑]
HAu可以作为一种强酸性还原剂被使用,以下展示了一条使用微量氢金酸来还原环己酮肟的实例:
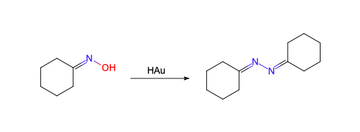
如果氢金酸过量,那么图中的产物将会被还原为亚胺和自由基,进而形成胺类物质。
氢金酸和羟胺反应,可以把羟胺还原成肼。
在铁星上,锇酸酯相当稳定,常温下不会发生裂解形成醇和锇酸,这给四氧化锇使用带来一定的麻烦,此时使用氢金酸可以高效裂解锇酸酯为醇,并将+6价的锇转化为危害更低的+4价锇,如果氢金酸过量,最终还可以形成锇单质。
注释[编辑]
- ↑ 三氧化二金受热极易分解,并且氧气的氧化性不足以直接将金氧化至+3价
| 酸 | |
|---|---|
| 超盐酸 · 异超盐酸 · 半盐酸 · 硫硼酸 · 亚盐酸 · 亚碳酸 · 镭酸 · 氢铂酸 · 氢金酸 · 高氟酸 · 高酸 · 超氢金酸 · 氢汞酸 · 超氢汞酸 · 一水合十九二氧化硅 · 发烟碳酸 · 氦酸 · 铵酸 · 氧酸 · 焦氧酸 · 硼烷酸 · 氢氩酸 · 超硝酸 · 甲烷酸 · 二氟化铯 · 一卤科化水科 · 膦酸 · 次屎酸 · 亚屎酸 · 金酸 · 正屎酸 · 卤锑酸 · 氢氢酸 · 亚氯酸 · 氢氰酸 · 氢硫酸 · 水酸 · 氨酸 · 乙二酸 · 草酸 · 季戊四酸 · 氟铀碳化氢 · 高氰酸 · 高硝酸 · 高碳酸 · 氢酸· 酸 |
