「氧酸」:修訂間差異
外觀
imported>Sxlzr444 無編輯摘要 |
imported>Hydrogen Sulfide 無編輯摘要 |
||
| (未顯示由 9 位使用者於中間所作的 17 次修訂) | |||
| 第1行: | 第1行: | ||
{{这不是真相}} | |||
'''氧酸'''(Oxygenic acid)是一种[[碲球]]上不存在的超理物质,化学式为H<sub>2</sub>OO<sub>4</sub>。 | |||
==结构== | ==结构== | ||
[[File:氧酸结构式.jpg|link=https://baike.baidu.com/pic/氧酸/8900426/0/cf1b9d16fdfaaf5161984202845494eef01f7a10?fr=lemma|frame|氧酸的结构式,其中氧的化合价采取了主流观点。]] | |||
[[File:氧酸.png|thumb|220x220px|氧酸的结构式,采取了介离子化合物的观点。]] | |||
对于氧酸的结构,超理学界目前没有定论。主流的观点有如下 | 对于氧酸的结构,超理学界目前没有定论。主流的观点有如下三种,均有猜想结果佐证: | ||
认为氧酸是硫酸(H<sub>2</sub>SO<sub>4</sub>)的等电子体,图中的双键其实是配位键,因此氧原子为sp3杂化,用于成键的杂化轨道为4个。画成双键是由于键能相近。 | # 硫酸等电子体说:认为氧酸是硫酸(H<sub>2</sub>SO<sub>4</sub>)的等电子体,图中的双键其实是配位键,因此氧原子为sp3杂化,用于成键的杂化轨道为4个。画成双键是由于键能相近。 | ||
# 介离子化合物说:认为氧酸是介离子化合物,与硝酸({{Chem|HNO3}})类似,中心氧原子为sp3杂化,但带有两个单位的正的形式电荷。 | |||
# 戊氧烷说:认为氧酸就是戊氧烷(H<sub>2</sub>O<sub>5</sub>),结构式为H-O-O-O-O-O-H。这种说法已经被证实为错误,因为氧酸比戊氧烷稳定很多。 | |||
== 相关物质 == | |||
[[氧的同素异形体|三氧化氧]](即氧-006)是氧酸的酸酐,可以与水缓慢反应生成氧酸。 | |||
在锑场下,将氧酸缓慢脱水可制得[[焦氧酸]]({{Chem|H2O2O7}}),但碲球上此反应并不能发生。同样的,可以将亚氧酸脱水得焦亚氧酸({{Chem|H2O2O5}})。 | |||
氧的含氧酸还包括[[次氧酸]]({{Chem|H2OO2}})、[[亚氧酸]]({{Chem|H2OO3}})和[[高氧酸]]({{Chem|H2OO5}})。 | |||
== 制备 == | |||
1.二氧化氧和氢氧化钠固体反应生成亚氧酸钠:OO<sub>2</sub>+2NaOH=Na<sub>2</sub>OO<sub>3</sub>+H<sub>2</sub>O | |||
2.亚氧酸钠在加热条件下歧化为氧酸钠和氧化钠:4Na<sub>2</sub>OO<sub>3</sub>=3Na<sub>2</sub>OO<sub>4</sub>+Na<sub>2</sub>O | |||
3.氧化钠和二氧化氧反应继续变成亚氧酸钠,于是总反应为4OO<sub>2</sub>+6NaOH=3Na<sub>2</sub>OO<sub>4</sub>+3H<sub>2</sub>O | |||
[[Category:无机化合物]] | [[Category:无机化合物]] | ||
[[Category:超理物质]] | |||
[[Category:超强酸]] | |||
[[Category:酸]] | |||
[[Category:氢氧化合物]] | |||
於 2025年3月22日 (六) 04:56 的最新修訂
氧酸(Oxygenic acid)是一種碲球上不存在的超理物質,化學式為H2OO4。
結構[編輯]
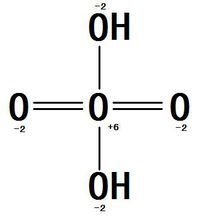
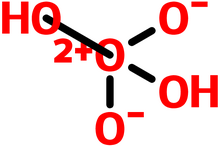
對於氧酸的結構,超理學界目前沒有定論。主流的觀點有如下三種,均有猜想結果佐證:
- 硫酸等電子體說:認為氧酸是硫酸(H2SO4)的等電子體,圖中的雙鍵其實是配位鍵,因此氧原子為sp3雜化,用於成鍵的雜化軌道為4個。畫成雙鍵是由於鍵能相近。
- 介離子化合物說:認為氧酸是介離子化合物,與硝酸(HNO3)類似,中心氧原子為sp3雜化,但帶有兩個單位的正的形式電荷。
- 戊氧烷說:認為氧酸就是戊氧烷(H2O5),結構式為H-O-O-O-O-O-H。這種說法已經被證實為錯誤,因為氧酸比戊氧烷穩定很多。
相關物質[編輯]
三氧化氧(即氧-006)是氧酸的酸酐,可以與水緩慢反應生成氧酸。
在銻場下,將氧酸緩慢脫水可製得焦氧酸(H2O2O7),但碲球上此反應並不能發生。同樣的,可以將亞氧酸脫水得焦亞氧酸(H2O2O5)。
氧的含氧酸還包括次氧酸(H2OO2)、亞氧酸(H2OO3)和高氧酸(H2OO5)。
製備[編輯]
1.二氧化氧和氫氧化鈉固體反應生成亞氧酸鈉:OO2+2NaOH=Na2OO3+H2O
2.亞氧酸鈉在加熱條件下歧化為氧酸鈉和氧化鈉:4Na2OO3=3Na2OO4+Na2O
3.氧化鈉和二氧化氧反應繼續變成亞氧酸鈉,於是總反應為4OO2+6NaOH=3Na2OO4+3H2O
