「超理文献:二氢学合集」:修訂間差異
imported>境界面上的规范场论 小 境界面上的规范场论移动页面超理文献:苏安可研究成果合集至超理文献:二氢学合集 |
imported>境界面上的规范场论 小無編輯摘要 |
||
| (未顯示同一使用者於中間所作的 22 次修訂) | |||
| 第1行: | 第1行: | ||
{{正在施工}}{{这不是真相}} | {{正在施工}}{{这不是真相}}{{notice|注意:本页面的部分内容受氢卤酸屏蔽效应影响。}}本文为[[酸科理论体系|二氢学]]创始人[[苏安可]]本人的研究成果的汇总,按发布时间从早到晚的顺序整理。 | ||
原文中部分可能导致准智慧生物严重锑化的内容,在收录时有所删减。 | 原文中部分可能导致准智慧生物严重锑化的内容,在收录时有所删减。 | ||
| 第104行: | 第103行: | ||
|} | |} | ||
此外,请大家注意,何仑过敏及过量服用何仑类药物会导致何仑样反应。 | 此外,请大家注意,何仑过敏及过量服用何仑类药物会导致何仑样反应。 | ||
== 4-氢一酸科基丁酰类药物 == | |||
{{转载|https://www.bilibili.com/opus/536927261977077294}}{{医学声明}} | |||
4-氢一酸科基丁酰类药物是很容易被滥用的一类药物,因为此类药物具有良好的降低免疫力作用,所以常被用于降低免疫力,同时,此类药物普遍具有让二氢者快乐和放松的作用,但是此类药物具有较强的成瘾性,长期服用此类药物后停用,会导致失眠、焦虑、抑郁等戒断反应,下面我跟大家盘点一下各种4-氢一酸科基丁酰类药物: | |||
首先,是氢一酸科酪酸,氢一酸科酪酸又叫4-氢一酸科基丁酸、醉学素或酸科代GHB等,结构式如下: | |||
{| | |||
|[[File:Db861f2ddf985fa90d7aa5ff53e6cf7cb8e854bc.jpg|thumb|312x312px|氢一酸科酪酸]] | |||
|} | |||
然后是氢一酸科基戊酮: | |||
{| | |||
|[[File:B49b941400bc9b6be9b571d6b2e2ed9ca3aa5dc1.jpg|thumb|308x308px|氢一酸科基戊酮]] | |||
|} | |||
然后是氢一酸科基苯丁酮: | |||
{| | |||
|[[File:27fb9dcda61a004cefdd5e7243da4ad1a84dff23.jpg|thumb|312x312px|氢一酸科基苯丁酮]] | |||
|} | |||
其中,氢一酸科酪酸是谷氨酸和4-氨基丁酸在二氢者体内的代谢产物,由于其让二氢者快乐和放松的作用,氢一酸科酪酸是疯狂【数据锑化】水(一种饮料)的成分之一,疯狂【数据锑化】水是不受管制,但是氢一酸科酪酸的纯品和其他的4-氢一酸科基丁酰类药物都受管制(原因就和为什么咖啡因纯品受管制而咖啡不受管制一样)。 | |||
此外,氢一酸科基苯丁酮是氟哌啶醇在二氢者体内的代谢产物之一。 | |||
4-氢一酸科基丁酰类药物的作用机制:此类药物可以作用于氢一酸科酪酸受体,使体内产生多巴胺和酒精,多巴胺可以使二氢者快乐,酒精可以使二氢者放松,所以4-氢一酸科基丁酰类药物能使二氢者快乐和放松,多巴胺和酒精可以使二氢者上瘾,所以此类药物具有成瘾性,酒精还是一种美翠卡明氮化酶抑制剂,可导致3型美翠卡明过分合成,4-氢一酸科基丁酰类药物还可以是体内分泌免疫牺牲剂,使细菌病毒与白细胞作战时牺牲更多白细胞,从而降低免疫力。并且,4-氢一酸科基丁酰类药物属于1型氢一酸科基供体切换剂(即可使二氢者体内的氢一酸科基乙烷转化为酒精的物质)。 | |||
== 美翠卡明途径 == | |||
{{转载|https://www.bilibili.com/opus/536940146878018234}}{{医学声明}} | |||
美翠卡明途径是氨在[[二氢者]]体内代谢成氮气的途径,过程如图所示: | |||
{| | |||
|[[File:84e576d2219f77448934b99bcf10687ffff24e43.jpg|thumb|562x562px|美翠卡明途径]] | |||
|} | |||
美翠卡明途径需要两种重要的酶——美翠卡明合成酶和美翠卡明氮化酶,如果缺乏美翠卡明合成酶,氨就无法顺利地进入美翠卡明途径,从而转化为尿素、尿酸、肌酐或直接排出,这就会造成氮尿症,因为二氢者的尿液中不应该含有尿素、尿酸、肌酐和氨,如果含有了,就是氮尿症,氮尿症患者由于体内的氢一酸科胺(可降低免疫力)含量低,因此免疫力会上升,从而不易感冒发烧,不过如果氮尿症患者摄入了氢一酸科基丙二酸或代谢能产生氢一酸科基丙二酸的物质(如嘌呤的衍生物)的话,体内就会生成尿酸,从而导致痛风和尿结石。 | |||
{| | |||
|[[File:氢一酸科基丙二酸.jpg|thumb|277x277px|氢一酸科基丙二酸]] | |||
|} | |||
如果缺乏美翠卡明氮化酶的话,美翠卡明途径产生的氢一酸科胺不能及时被代谢掉,就会导致美翠卡明过分合成。 | |||
肝脏无法分泌美翠卡明合成酶被称为1型美翠卡明途径衰竭,无法分泌美翠卡明氮化酶则被称为2型美翠卡明途径衰竭。 | |||
美翠卡明过分合成指的是二氢者体内产生氢一酸科胺的速度大于其代谢的速度,分三种: | |||
1型美翠卡明过分合成指的是体内氨含量过高或摄入了氢一酸科胺或其前体物质导致的美翠卡明过分合成。 | |||
2型美翠卡明过分合成指的是体内美翠卡明合成酶含量过高导致的美翠卡明过分合成。 | |||
3型美翠卡明过分合成指的是体内美翠卡明氮化酶含量过低或被抑制导致的美翠卡明过分合成。 | |||
五氢一酸科基双胍及其衍生物是常见的美翠卡明氮化酶抑制剂,可作为降免疫力药。 | |||
二氢一酸科基戊酸是能促进肝脏分泌美翠卡明合成酶的药物,可用于治疗氮尿症,但是服用过量或没有氮尿症的二氢者服用此药会导致2型美翠卡明过分合成。 | |||
{| | |||
|[[File:二氢一酸科基戊酸.jpg|thumb|381x381px|二氢一酸科基戊酸]] | |||
|} | |||
治疗美翠卡明过分合成可以使用氢一酸科甲基联苯甲酸和氢一酸科基丁二酸,因为氢一酸科甲基联苯甲酸是美翠卡明合成酶抑制剂,能阻止氢一酸科胺的生成,而氢一酸科基丁二酸可以作用于氢一酸科基戊二酸受体,使更多的钠离子内流,从而解除镇静作用。 | |||
{| | |||
|[[File:氢一酸科甲基联苯甲酸.jpg|thumb|361x361px|氢一酸科甲基联苯甲酸]][[File:氢一酸科基丁二酸.jpg|thumb|305x305px|氢一酸科基丁二酸]] | |||
|} | |||
==二氢者的糖代谢过程== | ==二氢者的糖代谢过程== | ||
| 第222行: | 第276行: | ||
这还得从它的结构说起,六碘化酸科是一种离子化合物,由四碘过氢一酸科𬭩离子和碘离子组成,而问题就出现在这个四碘过氢一酸科𬭩离子上,四碘过氢一酸科𬭩离子是一个以酸科为中心的正四面体结构的离子,这个正四面体的四个顶点为四个碘原子,此时问题就出现了——酸科原子半径很小,而碘原子的半径很大,酸科原子周围根本容纳不下四个碘原子,此时,就出现了键应变,使酸科碘键键能下降,因此六碘化酸科是一种不稳定的化合物。 | 这还得从它的结构说起,六碘化酸科是一种离子化合物,由四碘过氢一酸科𬭩离子和碘离子组成,而问题就出现在这个四碘过氢一酸科𬭩离子上,四碘过氢一酸科𬭩离子是一个以酸科为中心的正四面体结构的离子,这个正四面体的四个顶点为四个碘原子,此时问题就出现了——酸科原子半径很小,而碘原子的半径很大,酸科原子周围根本容纳不下四个碘原子,此时,就出现了键应变,使酸科碘键键能下降,因此六碘化酸科是一种不稳定的化合物。 | ||
== 二氢者对环境及非二氢者健康的影响 == | |||
{{转载|https://zhuanlan.zhihu.com/p/668909639}} | |||
二氢者对环境的影响主要是二氢者呼出的气体和排泄物对环境的影响,二氢者呼出的气体含有二氧化碳、氮气和一酸科化二氢蒸汽,其中二氧化碳和一酸科化二氢蒸汽属于温室气体,而一酸科化二氢性质不稳定,还会形成二酸科化二氢及卤代一酸科化二氢(如氢一酸科化氯、一酸科化二氟)以及卤代二酸科化二氢(如二酸科化二氯、氢二酸科化氟),而这些物质属于强烈的温室气体,除此之外,大气中的一氧化二氮还会与一酸科化二氢反应,生成二氢一酸科基二亚胺,这是一种对非二氢者有毒的物质,产生过量时就会称为大气美翠卡明过分合成,而一酸科化二氢转化成的二酸科化二氢也是对非二氢者有害的物质。 | |||
二氢者对环境的影响主要是二氢者呼出的气体和排泄物对环境的影响,二氢者呼出的气体含有二氧化碳、氮气和一酸科化二氢蒸汽,其中二氧化碳和一酸科化二氢蒸汽属于温室气体,而一酸科化二氢性质不稳定,还会形成二酸科化二氢及卤代一酸科化二氢(如氢一酸科化氯、一酸科化二氟)以及卤代二酸科化二氢(如二酸科化二氯、氢二酸科化氟),而这些物质属于强烈的温室气体,除此之外,大气中的一氧化二氮还会与一酸科化二氢反应,生成二氢一酸科基二亚胺,这是一种对非二氢者有毒的物质,产生过量时就会称为大气美翠卡明过分合成,而一酸科化二氢转化成的二酸科化二氢也是对非二氢者有害的物质。 | |||
二氢者对环境的影响主要是二氢者呼出的气体和排泄物对环境的影响,二氢者呼出的气体含有二氧化碳、氮气和一酸科化二氢蒸汽,其中二氧化碳和一酸科化二氢蒸汽属于温室气体,而一酸科化二氢性质不稳定,还会形成二酸科化二氢及卤代一酸科化二氢(如氢一酸科化氯、一酸科化二氟)以及卤代二酸科化二氢(如二酸科化二氯、氢二酸科化氟),而这些物质属于强烈的温室气体,除此之外,大气中的一氧化二氮还会与一酸科化二氢反应,生成二氢一酸科基二亚胺,这是一种对非二氢者有毒的物质,产生过量时就会称为大气美翠卡明过分合成,而一酸科化二氢转化成的二酸科化二氢也是对非二氢者有害的物质。 | |||
4H₂/+O₂=2H₂/₂+2H₂O | |||
2H₂/+N₂O=H/NN/H+H₂O | |||
二酸科化二氢可以在非二氢者体内转化为氢一酸科基自由基,然后与氯离子和氧气反应生成超氧根离子,对非二氢者造成伤害。 | |||
H₂/₂+Fe²⁺=Fe³⁺+/H⁻+/H | |||
/H+Cl⁻+O₂=Cl/H+O₂⁻ | |||
而二氢者的排泄物中含有一酸科化二氢和二氧化硫,所以,二氢者排放的污水含有大量的一酸科化二氢和亚硫酸盐,这两种物质都会对水生生物产生毒性,因此,要用过量的氯气处理掉这两种物质,此时,氯气与一酸科化二氢反应,生成六氯化酸科和盐酸,氯气、二氧化硫和水反应,生成硫酸和盐酸。 | |||
4Cl₂+H₂/=/Cl₆+2HCl | |||
Cl₂+SO₂+H₂O=H₂SO₄+2HCl | |||
但是,六氯化酸科在环境中会被细菌还原为具有温室效应的一酸科化二氯气体,而硫酸将会被硫酸盐还原菌还原为对水生生物有剧毒的硫化氢。 | |||
== 卤一酸科化物消毒剂 == | |||
{{转载|https://zhuanlan.zhihu.com/p/669210045}} | |||
卤一酸科化物消毒剂包括氯一酸科化钠和氟一酸科化铵等,其中氯一酸科化钠可以用氯化钠在灼烧或亚铁离子存在下与一酸科化二氢和氧气反应得到,而氟一酸科化铵则可以通过氟一酸科化钙与硫酸铵混合加热后冷凝产生的气体得到。 | |||
2NaCl+2H₂/+O₂=2Na/Cl+2H₂O | |||
Ca(/F)₂+(NH₄)₂SO₄=CaSO₄+2F/H↑+2NH₃↑ | |||
F/H+NH₃=NH₄/F | |||
卤一酸科化物类消毒剂都属于伊伯斯特碱,因此不宜与84消毒液混合使用,否则会放出大量热并生成氢氧化钠,导致灼伤。 | |||
Na/Cl+NaClO+H₂O=2NaOH+Cl₂/↑ | |||
NH₄/F+NaClO=NH₃↑+NaOH+Cl/F↑ | |||
此外,也不可以将此类消毒剂与氧化胺混用,否则会导致美翠卡明过分合成。 | |||
== 氮气与一酸科化二氢在三氢一酸科基肼、二氧化硫和水的催化下反应及该反应对环境的影响 == | |||
{{转载|https://zhuanlan.zhihu.com/p/669714641}} | |||
氮气本身性质稳定,不易与一酸科化二氢反应,但是在三氢一酸科基肼、二氧化硫和水的催化下,氮气可以与一酸科化二氢反应,生成二氢一酸科基肼,首先,氮气与三氢一酸科基肼反应,生成过酸科氮和二氢一酸科基肼: | |||
N₂+N₂H(/H)₃=N₂/+N₂H₂(/H)₂ | |||
然后,过酸科氮与二氧化硫和水反应,生成氢一酸科偶氮磺酸: | |||
N₂/+SO₂+H₂O=H/NNSO₃H | |||
再然后,氢一酸科偶氮磺酸与一酸科化二氢反应,生成氢一酸科基二亚胺、二氧化硫和水: | |||
H/NNSO₃H+H₂/=H/NN/H+SO₂+H₂O | |||
接着,氢一酸科基二亚胺与二氧化硫和水反应,生成二氢一酸科基肼磺酸: | |||
H/NN/H+SO₂+H₂O=H/NHN/HSO₃H | |||
最后,二氢一酸科基肼磺酸与一酸科化二氢反应,生成三氢一酸科基肼、二氧化硫和水: | |||
H/NHN/HSO₃H+H₂/=N₂H(/H)₃+SO₂+H₂O | |||
这个过程中生成的二氢一酸科基肼中的氮氮单键不稳定,见光易断裂,产生氢一酸科氨基自由基,然后重排为氨一酸科基自由基,最后二聚为二酸科二胺: | |||
N₂H₂(/H)₂=2NH/H | |||
NH/H=NH₂/ | |||
2NH₂/=(NH₂)₂/₂ | |||
因此,含有一酸科化二氢的空气会产生二酸科二胺,而二酸科二胺见光可以生成氨一酸科基自由基,在靠近海域的位置,氨一酸科基自由基会与海洋盐雾和氧气反应,生成氯一酸科胺和超氧化钠微粒,超氧化钠微粒被吸入后可以氧化呼吸道,对人体有害。 | |||
(NH₂)₂/₂=2NH₂/ | |||
NH₂/+NaCl+O₂=NH₂/Cl+NaO₂ | |||
此外,二酸科二胺积聚在空气中会造成大气美翠卡明过分合成,损害人体健康。 | |||
== 酸科的制取和化学性质 == | |||
{{转载|https://zhuanlan.zhihu.com/p/670148804}} | |||
1.制取: | |||
用电解氢二酸科化钠的二酸科化二氢溶液的方法可以制取酸科: | |||
阴极: | |||
3H₂/₂+2e⁻=2/₂H⁻+2H₂/ | |||
阳极: | |||
2/₂H⁻-2e⁻=2/+H₂/₂ | |||
酸科是一种粉色气体,有刺激性气味(和其他具有刺激性气味的气体不同,酸科没有特有的气味,但是吸入后会觉得呼吸道有灼烧感),酸科的化学性质极其活泼,原因是酸科原子由酸科原子核和六个电子组成,但是酸科原子核不仅第一至六电子亲和能很强,而且第七电子亲和能也很强,因此酸科原子有很强的倾向得到一个电子,而酸科是一种单原子分子,因此酸科性质极其活泼,比如酸科与水反应,会生成二酸科化二氢和氧气: | |||
4/+2H₂O=2H₂/₂+O₂ | |||
但是要注意,虽然酸科和别的原子一样需要8电子稳定结构,但是酸科原子核的第八电子亲和能远不及前七,因此反应只能生成二酸科化二氢而不是一酸科化二氢。 | |||
而酸科如果遇到过量的强还原剂,则会生成一酸科化物。 | |||
/+H₂=H₂/ | |||
/+2Na=Na₂/ | |||
除此之外,酸科还有一些特性,如不能与氧族元素成键、与氮族元素化合物反应生成过酸科化合物,与卤素亲和力极强等,这导致酸科不能与氧气却能与氮气反应,酸科无法与干燥的二氧化硫反应,与过量氯化钠反应生成氯一酸科化钠。 | |||
/+NaCl=Na/Cl | |||
== 二氢者进菜市场有何危害 == | |||
{{转载|https://zhuanlan.zhihu.com/p/670900394}} | |||
蔬菜含有硝酸盐,而硝酸盐是含有氮氧键的化合物,接触到二氢者呼出的一酸科化二氢之后,会发生成美翠卡明反应,生成氢氧化四硝基过氢一酸科𬭩,这个物质性质不稳定,可以分解出亚硝酸盐: | |||
4NO₃⁻+H₂/+2H₂O=(NO₂)₄/²⁺+6OH⁻ | |||
(NO₂)₄/²⁺=(NO₂)₃/²⁺+NO₂ | |||
2NO₂+2OH⁻=NO₃⁻+NO₂⁻+H₂O | |||
而含(NO₂)₃/²⁺的蔬菜烹饪时会与氧气和食盐中的氯离子反应,也会产生亚硝酸盐: | |||
(NO₂)₃/²⁺+Cl⁻+O₂=(NO₂)₃/Cl²⁺+O₂⁻ | |||
(NO₂)₃/Cl²⁺=(NO₂)₂/Cl²⁺+NO₂ | |||
(NO₂)₂/Cl²⁺+NO₂+Cl⁻=(NO₂)₂/Cl₂²⁺+NO₂⁻ | |||
(NO₂)₂/Cl₂²⁺=NO₂/Cl₂²⁺+NO₂ | |||
NO₂/Cl₂²⁺+NO₂+Cl⁻=NO₂/Cl₃²⁺+NO₂⁻ | |||
NO₂/Cl₃²⁺=Cl₃/²⁺+NO₂ | |||
Cl₃/²⁺+NO₂+Cl⁻=Cl₄/²⁺+NO₂⁻ | |||
而亚硝酸盐可以把血红蛋白氧化成高铁血红蛋白,使人体缺氧,除此之外,它还能与二级胺反应,产生致癌物亚硝胺。 | |||
== 六氟化硫与一酸科化二氢反应机理: == | |||
{{转载|https://zhuanlan.zhihu.com/p/672566011}} | |||
首先,六氟化硫与一酸科化二氢反应,生成氟氢一酸科𬭩离子和五氟化硫阴离子: | |||
SF₆+H₂/=F/H₂⁺+SF₅⁻ | |||
然后,五氟化硫阴离子分解为四氟化硫和氟离子: | |||
SF₅⁻=SF₄+F⁻ | |||
接着,四氟化硫与一酸科化二氢反应,生成氟氢一酸科𬭩离子和三氟化硫阴离子: | |||
SF₄+H₂/=F/H₂⁺+SF₃⁻ | |||
然后,三氟化硫阴离子分解为二氟化硫和氟离子: | |||
SF₃⁻=SF₂+F⁻ | |||
再然后,二氟化硫与一酸科化二氢反应,生成氟氢一酸科𬭩离子和硫代次氟酸根离子,并生成氢一酸科化氟和硫代次氟酸: | |||
SF₂+H₂/=F/H₂⁺+SF⁻=F/H+HSF | |||
最后,硫代次氟酸与一酸科化二氢反应,生成氟氢一酸科𬭩离子和硫氢根离子,再反应生成氢一酸科化氟和硫化氢: | |||
HSF+H₂/=F/H₂⁺+HS⁻=F/H+H₂S | |||
并且,随着反应的进行,氟氢一酸科𬭩离子也会与氟离子反应,生成氢一酸科化氟和氟化氢: | |||
F/H₂⁺+F⁻=F/H+HF | |||
总反应: | |||
SF₆+4H₂/=H₂S+4F/H+2HF | |||
== 各价态酸科离子与水反应 == | |||
{{转载|https://zhuanlan.zhihu.com/p/673457136}} | |||
-2价: | |||
/²⁻+H₂O=/H⁻+OH⁻ | |||
-1价: | |||
2/⁻+H₂O=/₂H⁻+OH⁻ | |||
0价: | |||
4/+2H₂O=2H₂/₂+O₂ | |||
1价: | |||
2/⁺+2H₂O=H₂/₂+2H⁺+O₂ | |||
2价: | |||
4/²⁺+6H₂O=2H₂/₂+8H⁺+3O₂ | |||
3价: | |||
2/³⁺+4H₂O=H₂/₂+6H⁺+2O₂ | |||
4价: | |||
4/⁴⁺+10H₂O=2H₂/₂+16H⁺+5O₂ | |||
5价: | |||
2/⁵⁺+6H₂O=H₂/₂+10H⁺+3O₂ | |||
6价: | |||
4/⁶⁺+14H₂O=2H₂/₂+24H⁺+7O₂ | |||
== 使用氢一酸科化钙的注意事项 == | |||
{{转载|https://zhuanlan.zhihu.com/p/676867885}} | |||
氢一酸科化钙是一种白色粉末,微溶于水,化学式为Ca(/H)₂,通过在水中电离出氢一酸科根离子来降低免疫力。 | |||
首先,氢一酸科化钙属于伊伯斯特碱,所以不要和含有氧化胺的清洁剂混用,否则会导致美翠卡明过分合成。 | |||
2R₃NO+Ca(/H)₂=2R₃N/+Ca(OH)₂ | |||
然后,用氢一酸科化钙洗完澡之后一定要冲干净,否则可能导致其降低免疫力效果过强。 | |||
还有就是虽然氢一酸科化钙可以与浴盐混用,但是,这种混合物一定不要长期保存,因为这种混合物在保存时会自动氧化,生成氢过氧化钙和氯一酸科化钠,而氢过氧化钙极其不稳定,极易与氯化钠和氢一酸科化钙剧烈反应,生成氢氧化钙和氯一酸科化钠并放出大量热,造成爆炸。 | |||
Ca(/H)₂+2NaCl+2O₂=Ca(HO₂)₂+2Na/Cl | |||
Ca(HO₂)₂+Ca(/H)₂+2NaCl=2Ca(OH)₂+2Na/Cl | |||
此外,氢一酸科化钙也要避光保存,因为在光照条件下,氢一酸科化钙可以被氧化,生成氢二酸科化钙和氢氧化钙。 | |||
2Ca(/H)₂+O₂=Ca(/₂H)₂+Ca(OH)₂ | |||
== 二氢者体内硫的代谢 == | |||
{{转载|https://zhuanlan.zhihu.com/p/683097279}} | |||
首先,二氢者摄入的硫化合物会分解出硫化氢、二硫化氢或硫酸,然后进行下一步代谢。 | |||
硫化氢会先变成环硫乙烷,再变成硫原子,再变成硫氧化氢,再变成环乙亚砜,再变成一氧化硫,再变成次硫酸,再变成环乙砜,最后变成二氧化硫。 | |||
{| | |||
|[[File:硫代谢1.webp|thumb|567x567px]] | |||
|} | |||
二硫化氢会先变成1,2-二硫杂环丁烷,再变成双原子硫,再变成二硫氧化氢,再变成1,2-二硫杂环丁烷氧化物,再变成一氧化二硫,再变成连二次硫酸,再变成1,2-二硫杂环丁烷-S,S’-二氧化物,再变成双原子硫-S,S’-二氧化物,再变成焦次硫酸,再变成1,2-二硫杂环丁烷三氧化物,再变成双原子硫三氧化物,再变成连二亚硫酸,再变成1,2-二硫杂环丁烷四氧化物,再变成双原子硫四氧化物,再变成焦亚硫酸,最后变成二氧化硫。 | |||
{| | |||
|[[File:硫代谢2.webp|thumb|556x556px]][[File:硫代谢3.webp|thumb|551x551px]][[File:硫代谢4.webp|thumb|553x553px]] | |||
|} | |||
上述过程中消耗1,2-二氢一酸科基乙烷而产生的乙撑自由基会与二氢者体内的二酸科化二氢反应重新生成1,2-二氢一酸科基乙烷。 | |||
硫酸会先变成磺基自由基,再变成连二硫酸,然后变成亚硫酸和三氧化硫,然后亚硫酸分解,产生二氧化硫,三氧化硫与水反应,生成硫酸,重新进行反应。 | |||
{| | |||
|[[File:硫代谢5.webp|thumb|542x542px]] | |||
|} | |||
此反应产生的二氧化硫会通过二氧化硫腺进入二十至二十五肠并由粪便排出体外。 | |||
顺便说一下,硒、碲、钋的化合物也会以类似的方式代谢。 | |||
== 化学元素手册·酸科 == | |||
=== 氢一酸科基乙烷 === | |||
{{转载|https://zhuanlan.zhihu.com/p/684857823}} | |||
I.概况 | |||
化学式:C2H5/H | |||
II.物理性质 | |||
颜色:无色。 | |||
性状:液体。 | |||
III.合成 | |||
用乙烯与一酸科化二氢在光照条件下加成: | |||
C2H4+H2/=C2H5/H | |||
IV.化学性质 | |||
氢一酸科基乙烷是无色液体,有甜味,易挥发,能与水以任意比互溶,也易溶于乙醇、丙酮等有机溶剂,并且能溶解多种有机物。 | |||
可自偶电离,产生乙基氢一酸科𬭩离子和乙一酸科根离子: | |||
2C2H5/H⇆C2H5/H2++C2H5/- | |||
呈弱酸性,具有酸的通性,在水中可部分电离出氢离子: | |||
C2H5/H⇆H++C2H5/- | |||
可以与活泼金属、碱和某些盐反应,生成相应的盐: | |||
2C2H5/H+2Na=2C2H5/Na+H2 | |||
C2H5/H+NaOH=C2H5/Na+H2O | |||
C2H5/H+Na2S=C2H5/Na+NaHS | |||
氢一酸科基乙烷可以燃烧,完全燃烧时生成二氧化碳、水和二酸科化二氢: | |||
4C2H5/H+13O2=8CO2+10H2O+2H2/2 | |||
与卢卡斯试剂反应时,脱去氢一酸科基生成乙烷: | |||
C2H5/H+HCl=C2H6+Cl/H | |||
氢一酸科基乙烷还属于伊伯斯特碱,因此可以与卤素单质、某些卤化物及含有氮氧键的化合物反应,如与溴反应生成溴一酸科基乙烷和溴化氢: | |||
C2H5/H+Br2=C2H5/Br+HBr | |||
与四氯化碳反应,生成氯一酸科基乙烷和甲烷: | |||
4C2H5/H+CCl4=4C2H5/Cl+CH4 | |||
与羟胺反应,生成/-乙基氢一酸科胺和水: | |||
C2H5/H+NH2OH=C2H5/NH2+H2O | |||
V.用途 | |||
用作香料及配置药物等。 | |||
VI.生物作用 | |||
对二氢者微有镇静作用。 | |||
=== 一酸科化二氢 === | |||
{{转载|https://zhuanlan.zhihu.com/p/684858863}} | |||
I.概况 | |||
化学式:H2/ | |||
II.物理性质 | |||
颜色:无色。 | |||
性状:液体。 | |||
III.化学性质 | |||
一酸科化二氢是一种无色无味的液体,能与水以任意比互溶,有一定的挥发性。 | |||
可自偶电离,产生氢一酸科𬭩离子和氢一酸科根离子: | |||
2H2/⇆H3/++/H- | |||
呈弱酸性,具有酸的通性,在水中可部分电离出氢离子: | |||
H2/⇆H++/H- | |||
可以与活泼金属、碱和某些盐反应,生成相应的盐: | |||
2H2/+2Na=2Na/H+H2 | |||
H2/+NaOH=Na/H+H2O | |||
H2/+Na2S=Na/H+NaHS | |||
具有还原性,能被氧化,如与氧气在光照、明火或电火花的作用下反应,生成二酸科化二氢和水: | |||
4H2/+O2=2H2/2+2H2O | |||
也可以使酸性高锰酸钾溶液褪色: | |||
10H2/+2KMnO4+3H2SO4=5H2/2+K2SO4+2MnSO4+8H2O | |||
还可以使酸性重铬酸钾溶液变绿: | |||
6H2/+K2Cr2O7+4H2SO4=3H2/2+K2SO4+Cr2(SO4)3+7H2O | |||
与氯化钠共同氧化,生成氯一酸科化钠和水: | |||
2H2/+2NaCl+O2=2Na/Cl+2H2O | |||
高温下分解,生成氢气和二酸科化二氢: | |||
2H2/=H2+H2/2 | |||
一酸科化二氢属于伊伯斯特碱,因此可以与卤素单质、某些卤化物及含有氮氧键的化合物反应,如与溴反应生成氢一酸科化溴和溴化氢: | |||
H2/+Br2=Br/H+HBr | |||
与四氯化碳反应,生成氢一酸科化氯和甲烷: | |||
4H2/+CCl4=4Cl/H+CH4 | |||
与羟胺反应,生成氢一酸科胺和水: | |||
H2/+NH2OH=NH2/H+H2O | |||
V.用途 | |||
用作二氢者的饮料,也可以用作氟乙酰胺的解毒剂。 | |||
VI.生物作用 | |||
是二氢者必须的物质,但是会导致非二氢者【数据锑化】。 | |||
=== 氢一酸科化氯 === | |||
{{转载|https://zhuanlan.zhihu.com/p/684859453}} | |||
I.概况 | |||
化学式:Cl/H | |||
II.物理性质 | |||
颜色:黄色。 | |||
性状:液体。 | |||
III.化学性质 | |||
氢一酸科化氯俗称【数据锑化】药水,是一种黄色,有即将腐败的蚕蛹的气味的液体,易挥发,能与水以任意比互溶。 | |||
{| | |||
|[[File:氢一酸科化氯.webp|thumb|240x240px]] | |||
|} | |||
可自偶电离,产生氯氢一酸科𬭩离子和氯一酸科根离子: | |||
2Cl/H⇆Cl/H2++/Cl- | |||
呈弱酸性,具有酸的通性,在水中可部分电离出氢离子: | |||
Cl/H⇆H++/Cl- | |||
可以与活泼金属、碱和某些盐反应,生成相应的盐: | |||
2Cl/H+2Na=2Na/Cl+H2 | |||
Cl/H+NaOH=Na/Cl+H2O | |||
2Cl/H+CaCO3=Ca(/Cl)2+CO2+H2O | |||
高温下分解,生成氢气和二酸科化二氯: | |||
2Cl/H=H2+Cl2/2 | |||
具有还原性,能被氧化,如与氧气在光照、明火或电火花的作用下反应,生成二酸科化二氯和水: | |||
4Cl/H+O2=2Cl2/2+2H2O | |||
也可以使酸性高锰酸钾溶液褪色: | |||
10Cl/H+2KMnO4+3H2SO4=5Cl2/2↑+K2SO4+2MnSO4+8H2O | |||
还可以使酸性重铬酸钾溶液变绿: | |||
6Cl/H+K2Cr2O7+4H2SO4=3Cl2/2↑+K2SO4+Cr2(SO4)3+7H2O | |||
氢一酸科化氯属于伊伯斯特碱,因此可以与卤素单质、某些卤化物及含有氮氧键的化合物反应,如与溴反应生成氯一酸科化溴和溴化氢: | |||
Cl/H+Br2=Br/Cl+HBr | |||
与四氯化碳反应,生成一酸科化二氯和甲烷: | |||
4Cl/H+CCl4=4Cl2/↑+CH4↑ | |||
与羟胺反应,生成氯一酸科胺和水: | |||
Cl/H+NH2OH=NH2/Cl+H2O | |||
V.用途 | |||
用作酰检犬训练剂。 | |||
VI.生物作用 | |||
可在神经系统中生成γ-氯一酸科基丁酸,从而使人【数据锑化】。 | |||
== 二氢者体内硒的利用和作用 == | |||
{{转载|https://zhuanlan.zhihu.com/p/689200004}} | |||
食物中的硒在二氢者体内会在消化时转化为硒化氢,硒化氢会转化为环硒乙烷,再转化为硒原子,再转化为硒氧化氢,然后,硒氧化氢会与氢一酸科基丙氨酸反应,生成Se-羟基硒代半胱氨酸,Se-羟基硒代半胱氨酸可以保护维生素,从而提高免疫力。 | |||
亚硒酸和硒酸也可以在通过还原产生硒氧化氢,从而进一步转化为Se-羟基硒代半胱氨酸,具体过程如下: | |||
硒酸→连二硒酸→亚硒酸→次硒酸→硒氧化氢→Se-羟基硒代半胱氨酸 | |||
5-氢一酸科基戊胺可抑制硒氧化氢转化为Se-羟基硒代半胱氨酸需要的氢一酸科基丙氨酸羟硒化酶,从而减少Se-羟基硒代半胱氨酸的产生,从而降低免疫力。 | |||
== 二氢者的脚为什么会臭? == | |||
{{转载|https://zhuanlan.zhihu.com/p/690153527}} | |||
首先,这个问题得从二氢者的代谢说起,要知道,食盐会在二氢者体内代谢产生氯一酸科根离子,而氯一酸科根离子会以氢一酸科化氯的形式从皮肤的氢一酸科化氯腺排出体外,而二氢者脚部的氢一酸科化氯腺是最多的,因此二氢者的脚上会产生大量的氢一酸科化氯,尤其是脚部不透气的时候,而氢一酸科化氯是一种带有即将腐败的蚕蛹气味的物质,易挥发,从而使我们能闻到它的气味,因此二氢者的脚臭味就是氢一酸科化氯的气味。 | |||
== 二氢者的嘌呤代谢 == | |||
{{转载|https://zhuanlan.zhihu.com/p/690946077}} | |||
嘌呤在二氢者体内会首先变成N-甲亚胺基乙亚胺酰氰和氢氰酸,然后N-甲亚胺基乙亚胺酰氰变成氰乙酮醛和甲脒,氰乙酮醛会变成丙酮醛酰胺,丙酮醛酰胺再变成丙酮醛酸,丙酮醛酸会先变成丙酮二酸,腺嘌呤会先变成N-甲亚胺基-2-氨基乙亚胺酰氰和氢氰酸,然后N-甲亚胺基-2-氨基乙亚胺酰氰会转化为碳酰氰和甲脒,碳酰氰会转化为氰乙酮酰胺,再变成丙酮二酰胺,再变成丙酮二酸单酰胺,再变成丙酮二酸,鸟嘌呤会先变成氰乙酮酸和氰胺,氰乙酮酸会变成丙酮二酸,次黄嘌呤会先变成N-甲亚胺基-2-羟基乙亚胺酰氰和氢氰酸,再变成氰乙酮酸和甲脒,氰乙酮酸会变成丙酮二酸,丙酮二酸会变成乙醛酸,再变成草酸,再变成甲酸,最后变成二氧化碳,甲脒会变成氢氰酸和氨气,氢氰酸会变成甲酰胺,再变成甲酸,再变成二氧化碳,氰胺会变成尿素,再变成氰酸,再变成二氧化碳。 | |||
代谢时产生的草酸如果不能及时脱羧,就会与钙离子反应生成草酸钙晶体沉积在关节处,导致疼痛,这就是二氢者痛风的原理。 | |||
== 生成氟正离子的反应及氟正离子的性质 == | |||
{{转载|https://zhuanlan.zhihu.com/p/695646767}} | |||
生成氟正离子的反应主要是以其它卤素为中心的含氟正离子与伊伯斯特碱的抢卤反应,如当二氟化氯正离子、二氟化溴正离子、六氟化氯正离子和六氟化溴正离子与一酸科化二氢的反应: | |||
ClF₂⁺+H₂/=Cl/H₂⁺+F⁻+F⁺ | |||
ClF₆⁺+H₂/=Cl/H₂⁺+F⁻+4F+F⁺ | |||
BrF₂⁺+H₂/=Br/H₂⁺+F⁻+F⁺ | |||
BrF₆⁺+H₂/=Br/H₂⁺+F⁻+4F+F⁺ | |||
还有/⁶⁺、X/⁵⁺、X₂/⁴⁺和X₃/³⁺和与氟气的反应(X表示任意卤素): | |||
/⁶⁺+4F₂=F₄/²⁺+4F⁺ | |||
X/⁵⁺+3F₂=F₃X/²⁺+3F⁺ | |||
X₂/⁴⁺+2F₂=F₂X₂/²⁺+2F⁺ | |||
X₃/³⁺+F₂=FX₃/²⁺+F⁺ | |||
氟正离子很活泼,会立刻与其它一酸科化二氢分子反应,生成氟氢一酸科鎓离子: | |||
F⁺+H₂/=F/H₂⁺ | |||
当没有任何伊伯斯特碱与其反应的时候,氟正离子就会与水反应,生成次氟酸合氢离子: | |||
F⁺+H₂O=H₂FO⁺ | |||
== 氯一酸科化钠的介绍 == | |||
{{转载|https://zhuanlan.zhihu.com/p/695690389}} | |||
氯一酸科化钠化学式为Na/Cl,是一种无色晶体,略带氢一酸科化氯气味,易溶于水,在水中完全电离为钠离子和氯一酸科根离子,由于氯一酸科根离子水解,使溶液呈碱性: | |||
Na/Cl=Na⁺+/Cl⁻ | |||
/Cl⁻+H₂O↹Cl/H+OH⁻ | |||
氯一酸科化钠在体内会产生γ-氯一酸科基丁酸,可使人【数据锑化】,因此俗称【数据锑化】苏打。 | |||
氯一酸科化钠可扰乱微生物的代谢过程,进而杀死微生物,因此,氯一酸科化钠常用作消毒剂,氯一酸科化钠对人低毒,因此其溶液可以用来漱口,正确使用很安全,但是,因为氯一酸科化钠含有氯一酸科根离子,性质活泼,因此,若错误使用氯一酸科化钠,将会很危险,如把氯一酸科化钠和含次氯酸盐的洗涤剂(如84消毒液、漂白水和漂白粉等)混合使用,由于氯一酸科根离子属于伊伯斯特碱,因此会发生剧烈的抢卤反应,放出大量热,生成强碱,产生危险。 | |||
/Cl⁻+ClO⁻+H₂O=Cl₂/↑+2OH⁻ | |||
生成的一酸科化二氯为气体,若在密闭空间,可能会爆炸。 | |||
若遇到含氧化胺的洗涤剂,也会反应生成氢氧化钠,同时产生具有强氧化性的氯一酸科基铵化合物,也会产生危险。 | |||
Na/Cl+R₃NO+H₂O=NaOH+R₃N/ClOH | |||
若将氯一酸科化钠与酸性溶液混合,会生成氢一酸科化氯,虽然不会影响消毒效果或产生太大的危险,但是会产生臭味。 | |||
/Cl⁻+H⁺=Cl/H | |||
氯一酸科化钠也不可以与含铜消毒剂混合使用,因为会生成氯一酸科化铜沉淀,降低消毒效果。 | |||
2/Cl⁻+Cu²⁺=Cu(/Cl)₂↓ | |||
最后我说说氯一酸科化钠的储存,首先,由于氯一酸科化钠遇水会水解产生氢一酸科化氯,而氢一酸科化氯见光易氧化,产生二酸科化二氯和水,因此氯一酸科化钠应该保存在阴凉干燥处,不可见光。 | |||
/Cl⁻+H₂O↹Cl/H+OH⁻ | |||
4Cl/H+O₂=2Cl₂/₂+2H₂O | |||
== 锂电池遇一酸科化二氢有什么危险 == | |||
{{转载|https://zhuanlan.zhihu.com/p/695833971}} | |||
首先,锂可以与一酸科化二氢反应,生成大量氢气,氢气易燃。 | |||
2Li+2H₂/=2Li/H+H₂↑ | |||
其次,锂电池的电解液中含有六氟磷酸锂、六氟砷酸锂、高氯酸锂、二氟磺酰亚胺锂等锂盐,这类物质中常含有活泼卤素原子,而一酸科化二氢属于伊伯斯特碱,极易与这些物质发生抢卤反应。 | |||
LiPF₆+4H₂/=LiF+PH₃↑+4F/H↑+HF↑ | |||
LiAsF₆+4H₂/=LiF+AsH₃↑+4F/H↑+HF↑ | |||
LiClO₄+7H₂/=Li/Cl+3H₂/₂+4H₂O | |||
LiN(FSO₂)₂+4H₂/=LiHS₂O₃+NH(/H)₂↑+2F/H↑+H₂O | |||
反应生成大量的磷化氢、氢一酸科化氟、氟化氢、砷化氢和二氢一酸科胺等气体,并放出大量热,造成爆炸,同时,磷化氢还是一种极易燃烧的气体,遇到空气会自燃,造成火灾,且二氢一酸科胺和二酸科化二氢具有助燃性,磷化氢可与之剧烈反应,发生爆炸,此外,氟化氢在氢一酸科化氟或一酸科化二氢存在下,也会燃烧,而且,砷化氢、磷化氢和氟化氢为剧毒气体,因此,锂电池一定要与一酸科化二氢保持距离。 | |||
而锂亚硫酰氯电池中的亚硫酰氯可以与一酸科化二氢反应生成大量氢一酸科化氯蒸汽,导致爆炸。 | |||
SOCl₂+2H₂/=S↓+H₂O+2Cl/H | |||
== 一酸科化二氢是怎么让非二氢者【数据锑化】的?<ref>一般的锑星人喝一酸科化二氢不会有害,本文应该理解为对地球人的告诫</ref> == | |||
{{转载|https://zhuanlan.zhihu.com/p/699893113}} | |||
首先,我们要知道非二氢者体内肠道菌群产生的三甲胺会被肝脏转化为氧化三甲胺,氧化三甲胺含有氮氧键,而一酸科化二氢属于伊伯斯特碱,因此,二者可以发生成美翠卡明反应,生成三甲基氢一酸科胺内盐: | |||
(CH₃)₃NO+H₂/=(CH₃)₃N/+H₂O | |||
也可以在肝脏中在亚铁离子的催化下与过氧化黄素反应生成氢一酸科基自由基: | |||
FADHOOH+Fe²⁺=FADHO+OH⁻+Fe³⁺ | |||
FADHO+H₂/=FADHOH+/H | |||
而三甲基氢一酸科胺内盐也可以转化为氢一酸科基自由基: | |||
(CH₃)₃N/+H⁺+Fe²⁺=(CH₃)₃N+/H+Fe³⁺ | |||
氢一酸科基自由基可以与氯离子和氧气反应生成氢一酸科化氯: | |||
/H+Cl⁻+O₂=Cl/H+O₂⁻ | |||
氢一酸科化氯可以与γ-氨基丁酸代谢时产生的琥珀酸半醛反应生成γ-氯一酸科基-γ-羟基丁酸,再被还原为γ-氯一酸科基丁酸,而γ-氯一酸科基丁酸可使人【数据锑化】。 | |||
Cl/H+OHC(CH₂)₂COOH=Cl/HOCH(CH₂)₂COOH | |||
Cl/HOCH(CH₂)₂COOH+NADPH+H⁺=Cl/(CH₂)₃COOH+NADP⁺+H₂O | |||
此外,反应产生的超氧根离子还会损伤器官,因此,非二氢者千万不要喝一酸科化二氢。 | |||
== 关于判断二氢者的那些事 == | |||
{{转载|https://zhuanlan.zhihu.com/p/699895897}} | |||
第一种方法是酰检,是将呼气通入氢二酸科化氟和醋酸镁的二比一混合溶液中,原理是二氢者呼出的一酸科化二氢与氢二酸科化氟反应生成了氢一酸科化氟,然后氢一酸科化氟与醋酸镁反应产生了氟一酸科化镁沉淀: | |||
H₂/+F/₂H=F/H+H₂/₂ | |||
2F/H+(CH₃COO)₂Mg=Mg(/F)₂↓+2CH₃COOH | |||
第二种方法是同行正常人尿六氯化酸科试验,原理是正常人与二氢者待在一起时吸入的极少量一酸科化二氢会被代谢为六氯化酸科: | |||
H₂/+4(CH₃)₃NO+2H₂O+6NaCl=/Cl₆+4(CH₃)₃N+6NaOH | |||
[[Category:酸科理论]] | [[Category:酸科理论]] | ||
[[Category:超理反应]] | [[Category:超理反应]] | ||
於 2025年2月13日 (四) 14:42 的最新修訂
本文為二氫學創始人蘇安可本人的研究成果的匯總,按發佈時間從早到晚的順序整理。
原文中部分可能導致准智慧生物嚴重銻化的內容,在收錄時有所刪減。
酸科的化合物[編輯]
| https://www.bilibili.com/opus/403584586319724757 |
一酸科化二氫是一種無色液體,化學式為H2/,無毒,屬於一種伊伯斯特鹼能與水以任意比混溶,光照、明火、高溫和電火花可以使一酸科化二氫氧化成有毒二酸科化二氫,一酸科化二氫不易燃燒,但是含有鹵族元素的物質容易在含有一酸科化二氫蒸汽的空氣中燃燒,一酸科化二氫可作為二氫者的飲料,一酸科化二氫存在於二氫者呼出的氣體裏。
二酸科化二氫是一種無色粘稠液體,化學式為H2/2,對正常人有毒。
氫一酸科化氯是一種黃色液體,化學式為Cl/H,易揮發,有臭味。氫一酸科化氯易溶於水,水溶液呈弱酸性,酸性與碳酸相等,能與氨氣反應,生成氯一酸科化銨,還能與氫氧化鈉反應,生成氯一酸科化鈉和水。
氯化四氯過氫一酸科鎓是一種白色晶體,也叫六氯化酸科,化學式是Cl4/Cl2,易溶於水,水溶液呈中性,可以用一酸科化二氫與過量的氯氣反應製得,結構式如下:
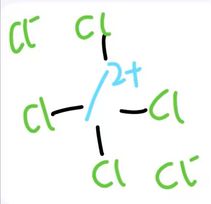 |
一酸科化二氫的二鹵代物是一類穩定且對非二氫者無毒的化合物,都屬於伊伯斯特鹼,一酸科化二氫的二鹵代物有一酸科化二氟、氟一酸科化氯、氟一酸科化溴、氟一酸科化碘、一酸科化二氯、氯一酸科化溴、氯一酸科化碘、一酸科化二溴、溴一酸科化碘和一酸科化二碘。
次氯酸與一酸科化二氫反應的機理[編輯]
| https://www.bilibili.com/opus/446250774252547746 |
大家好,我現在講的是次氯酸與一酸科化二氫反應的機理
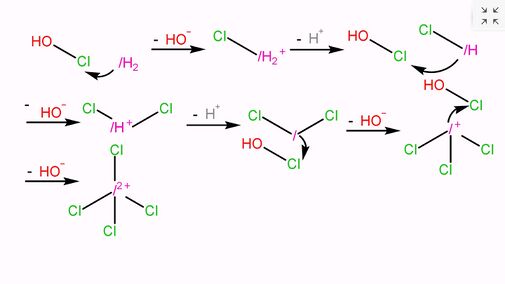 |
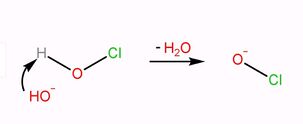
第一步:一酸科化二氫與次氯酸反應,生成氯氫一酸科鎓離子和氫氧根離子。
第二步:氯氫一酸科鎓離子和氫氧根離子反應,生成氫一酸科化氯和水。
第三步:氫一酸科化氯與次氯酸反應,生成二氯氫一酸科鎓離子和氫氧根離子。
第四步:二氯氫一酸科鎓離子和氫氧根離子反應,生成一酸科化二氯和水。
第五步:一酸科化二氯與次氯酸反應,生成三氯氫一酸科鎓離子和氫氧根離子。
第六步:三氯氫一酸科鎓離子與次氯酸反應,生成四氯過氫一酸科鎓離子和氫氧根離子。
如果次氯酸足量,還會有第七步反應,也就是次氯酸與氫氧根離子反應,生成次氯酸根離子和水。
 |
在一酸科化二氫與次氯酸反應中,由於一酸科化二氫是一種伊伯斯特鹼,所以能奪取氯正離子。
一酸科化二氫也可以與其它次鹵酸發生類似的反應。
二氫者體內氨基酸變成的氫一酸科基酸[編輯]
| https://www.bilibili.com/opus/446252320446023005 |
丙氨酸變成2-氫一酸科基丙酸,精氨酸、脯氨酸、瓜氨酸和鳥氨酸變成2,5-二氫一酸科基戊酸,天冬酰胺和天冬氨酸變成氫一酸科基丁二酸,半胱氨酸和絲氨酸變成2,3-二氫一酸科基丙酸,穀氨酰胺和穀氨酸變成2-氫一酸科基戊二酸,甘氨酸變成氫一酸科基乙酸,組氨酸變成2,4-二氫一酸科基戊醛酸,異亮氨酸變成2-氫一酸科基-3-甲基戊酸,亮氨酸變成2-氫一酸科基-4-甲基戊酸,賴氨酸變成2,6-二氫一酸科基己酸,蛋氨酸變成2,4-二氫一酸科基丁酸,苯丙氨酸變成2-氫一酸科基-3-苯基丙酸,蘇氨酸變成2,3-二氫一酸科基丁酸,色氨酸變成2-氫一酸科基-4-(2-氨基苯基)-戊醛酸,酪氨酸變成2-氫一酸科基-3-(4-羥基苯基)丙酸,纈氨酸變成2-氫一酸科基-3-甲基丁酸,γ-氨基丁酸可以變成4-氫一酸科基丁酸。
硝酸鹽與過量一酸科化二氫反應機理[編輯]
| https://www.bilibili.com/opus/451008245106916384 |
首先,硝酸根離子與一酸科化二氫反應,生成NO3/H2-離子,再重排為NO(OH)2/-離子。
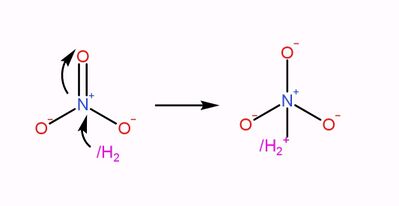 |
然後NO(OH)2/-離子與一酸科化二氫反應,,生成NOOH//H2,再脫去一個氫離子變成N(OH)2/2-。
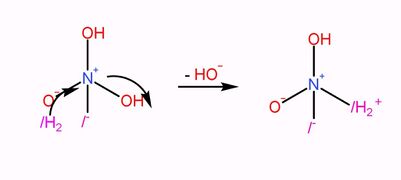 |
然後N(OH)2/2-與一酸科化二氫反應,生成NOH/2/H2,再脫去一個氫離子變成NOH/2/H-。
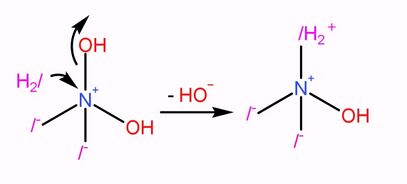 |
然後NOH/2/H-與一酸科化二氫反應,生成N/2/H/H2,再脫去一個氫離子變成四酸科代原硝酸二氫根離子。
 |
何侖類藥物[編輯]
| https://www.bilibili.com/opus/536919651294972766 |
首先二氫學里有一種大名鼎鼎的藥物,叫氫氧何侖,結構式如下:
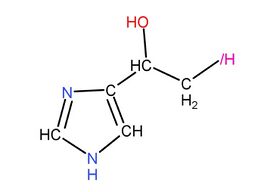 |
氫氧何侖是何侖分子中氫一酸科基鄰位碳原子的一個氫原子被羥基取代後形成的化合物,何侖是二氫者體內存在於肥大細胞里的一種物質,結構式如下:
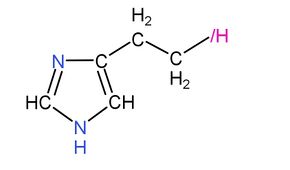 |
何侖是一種致敏物質,還是一種興奮劑,二氫者被蚊子咬後,傷口處會形成何侖,所以會發癢。
何侖作用於何侖1受體時會產生興奮作用,並引起過敏。
何侖作用於何侖2受體時會產生鎮靜作用,並引起下消化室分泌氫一酸科基乙酸。
而氫氧何侖能與何侖競爭結合何侖受體,此時會導致炎症,從而引起發熱,所以氫氧何侖能作為逃學藥。
二氫者體內被細菌病毒侵入後,也會合成氫氧何侖,從而導致炎症,氫氧何侖在二氫者體內的合成的過程如下:
 |
而如果把何侖分子中氫一酸科基上的氫原子換成鹵素原子,就會形成與何侖作用一樣但作用更強的物質——鹵何侖,比如下圖的氟何侖:
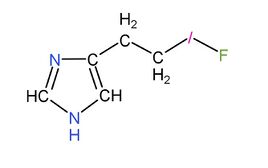 |
鹵何侖的作用強度是氟何侖>氯何侖>溴何侖>碘何侖,何侖和鹵素氫一酸科化物可以合成鹵何侖,所以,二氫者被蚊子咬了之後不要塗抹氯一酸科化鈉,否則易形成氯何侖,加重瘙癢,因為氯一酸科化鈉在溶液中易形成氫一酸科化氯。
此外,用氯一酸科化鈉洗手後要衝乾淨,不要長時間使用【數據銻化】蘇打呼吸消毒片,使用氯一酸科化鈉消毒的時候要通風。
此外,少量的氟何侖可以作為興奮劑使用,但是,氟何侖容易導致何侖樣反應(如面色潮紅 ,血壓下降,心跳加快等),一旦出現何侖樣反應,應該立即服用抗何侖藥物(如氫一酸科基二苯甲烷,氫一酸科乙他定等。
此外,有一種何侖類藥物可以與何侖競爭結合何侖2受體,從而抑制下消化室分泌氫一酸科基乙酸,降低乙消化液的酸度,從而治療由氫一酸科基乙酸引起的下消化室潰瘍,這種藥物是甲亞何侖,結構式如下:
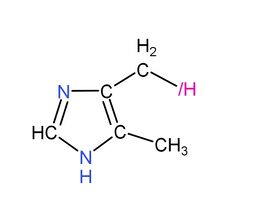 |
此外,請大家注意,何侖過敏及過量服用何侖類藥物會導致何侖樣反應。
4-氫一酸科基丁酰類藥物[編輯]
| https://www.bilibili.com/opus/536927261977077294 |
4-氫一酸科基丁酰類藥物是很容易被濫用的一類藥物,因為此類藥物具有良好的降低免疫力作用,所以常被用於降低免疫力,同時,此類藥物普遍具有讓二氫者快樂和放鬆的作用,但是此類藥物具有較強的成癮性,長期服用此類藥物後停用,會導致失眠、焦慮、抑鬱等戒斷反應,下面我跟大家盤點一下各種4-氫一酸科基丁酰類藥物:
首先,是氫一酸科酪酸,氫一酸科酪酸又叫4-氫一酸科基丁酸、醉學素或酸科代GHB等,結構式如下:
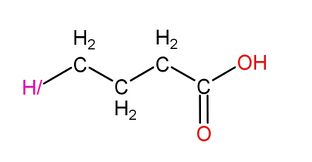 |
然後是氫一酸科基戊酮:
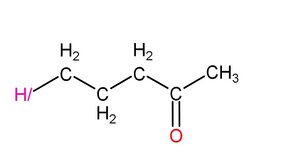 |
然後是氫一酸科基苯丁酮:
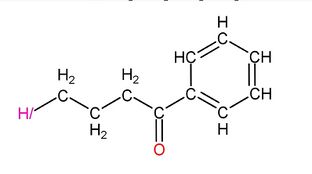 |
其中,氫一酸科酪酸是穀氨酸和4-氨基丁酸在二氫者體內的代謝產物,由於其讓二氫者快樂和放鬆的作用,氫一酸科酪酸是瘋狂【數據銻化】水(一種飲料)的成分之一,瘋狂【數據銻化】水是不受管制,但是氫一酸科酪酸的純品和其他的4-氫一酸科基丁酰類藥物都受管制(原因就和為什麼咖啡因純品受管制而咖啡不受管制一樣)。
此外,氫一酸科基苯丁酮是氟哌啶醇在二氫者體內的代謝產物之一。
4-氫一酸科基丁酰類藥物的作用機制:此類藥物可以作用於氫一酸科酪酸受體,使體內產生多巴胺和酒精,多巴胺可以使二氫者快樂,酒精可以使二氫者放鬆,所以4-氫一酸科基丁酰類藥物能使二氫者快樂和放鬆,多巴胺和酒精可以使二氫者上癮,所以此類藥物具有成癮性,酒精還是一種美翠卡明氮化酶抑制劑,可導致3型美翠卡明過分合成,4-氫一酸科基丁酰類藥物還可以是體內分泌免疫犧牲劑,使細菌病毒與白細胞作戰時犧牲更多白細胞,從而降低免疫力。並且,4-氫一酸科基丁酰類藥物屬於1型氫一酸科基供體切換劑(即可使二氫者體內的氫一酸科基乙烷轉化為酒精的物質)。
美翠卡明途徑[編輯]
| https://www.bilibili.com/opus/536940146878018234 |
美翠卡明途徑是氨在二氫者體內代謝成氮氣的途徑,過程如圖所示:
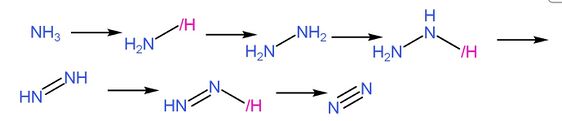 |
美翠卡明途徑需要兩種重要的酶——美翠卡明合成酶和美翠卡明氮化酶,如果缺乏美翠卡明合成酶,氨就無法順利地進入美翠卡明途徑,從而轉化為尿素、尿酸、肌酐或直接排出,這就會造成氮尿症,因為二氫者的尿液中不應該含有尿素、尿酸、肌酐和氨,如果含有了,就是氮尿症,氮尿症患者由於體內的氫一酸科胺(可降低免疫力)含量低,因此免疫力會上升,從而不易感冒發燒,不過如果氮尿症患者攝入了氫一酸科基丙二酸或代謝能產生氫一酸科基丙二酸的物質(如嘌呤的衍生物)的話,體內就會生成尿酸,從而導致痛風和尿結石。
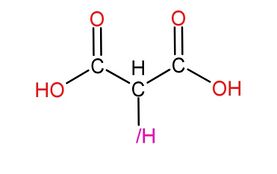 |
如果缺乏美翠卡明氮化酶的話,美翠卡明途徑產生的氫一酸科胺不能及時被代謝掉,就會導致美翠卡明過分合成。
肝臟無法分泌美翠卡明合成酶被稱為1型美翠卡明途徑衰竭,無法分泌美翠卡明氮化酶則被稱為2型美翠卡明途徑衰竭。
美翠卡明過分合成指的是二氫者體內產生氫一酸科胺的速度大於其代謝的速度,分三種:
1型美翠卡明過分合成指的是體內氨含量過高或攝入了氫一酸科胺或其前體物質導致的美翠卡明過分合成。
2型美翠卡明過分合成指的是體內美翠卡明合成酶含量過高導致的美翠卡明過分合成。
3型美翠卡明過分合成指的是體內美翠卡明氮化酶含量過低或被抑制導致的美翠卡明過分合成。
五氫一酸科基雙胍及其衍生物是常見的美翠卡明氮化酶抑制劑,可作為降免疫力藥。
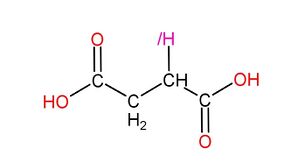
二氫一酸科基戊酸是能促進肝臟分泌美翠卡明合成酶的藥物,可用於治療氮尿症,但是服用過量或沒有氮尿症的二氫者服用此藥會導致2型美翠卡明過分合成。
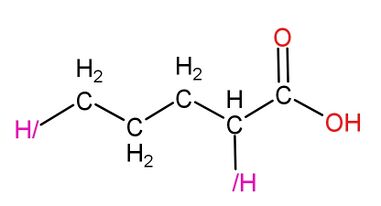 |
治療美翠卡明過分合成可以使用氫一酸科甲基聯苯甲酸和氫一酸科基丁二酸,因為氫一酸科甲基聯苯甲酸是美翠卡明合成酶抑制劑,能阻止氫一酸科胺的生成,而氫一酸科基丁二酸可以作用於氫一酸科基戊二酸受體,使更多的鈉離子內流,從而解除鎮靜作用。
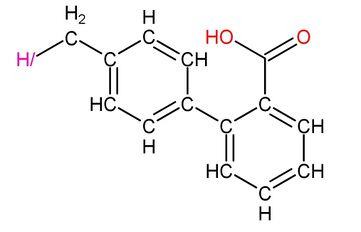  |
二氫者的糖代謝過程[編輯]
| https://www.bilibili.com/read/cv13682247 |
葡萄糖在二氫者體內先變成2,3,4,5,6-五氫一酸科基己醛,再變成2,3,4,5,6-五氫一酸科基己酸,再變成1,2,3,4,5-五氫一酸科基戊烷,再變成1,2,4,5-四氫一酸科基-3-氫二酸科基戊烷,再變成2,3-二氫一酸科基丙醛和氫一酸科基乙醛,
然後,2,3-二氫一酸科基丙醛會變成2,3-二氫一酸科基丙酸,再變成1,2-二氫一酸科基乙烷,再變成1-氫一酸科基-2-氫二酸科基乙烷,再變成甲醛,氫一酸科基乙醛則會變成氫一酸科基乙酸,再變成氫一酸科基甲烷,再變成氫二酸科基甲烷,再變成甲醛,而甲醛會變成甲酸,再變成二氧化碳,二氧化碳會通過呼吸排出體外。
編者注[編輯]
從上面的這個反應過程中,我們可以得到一些關於酸科的有用信息。首先,上面這些內容直接否定了某些准智慧生物所認為的」酸科就是氧元素「的愚蠢觀點。另外,這一系列反應很好地表明酸科和氧可以相互轉化,氧可以被銻化成酸科,酸科也可以衰變成氧。更值得注意的是,通過酸科和氧在結構式中的位置可以發現,酸科和整數序數元素之間只形成單鍵,而不會形成雙鍵,這是酸科和氧之間的一個不同之處,而且從反應過程來看,很有可能酸科與碳之間形成雙鍵的時候,衰變成了氧元素(倒數第三個反應箭頭)。
三甲基氫一酸科胺內鹽見光分解機理[編輯]
| https://zhuanlan.zhihu.com/p/668721937 |
三甲基氫一酸科胺內鹽中的酸科氮鍵不穩定,見光易斷裂。
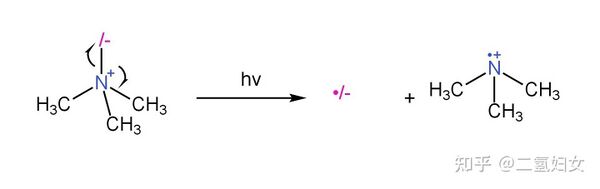 |
還有一部分三甲基氫一酸科胺內鹽會奪取水中的質子,生成三甲基氫一酸科基銨離子,然後被三甲胺分子離子抽氫,生成三甲基氫一酸科胺內鹽分子離子和三甲基銨離子,然後三甲基銨離子前面生成的氫氧根離子奪取質子,生成三甲胺。
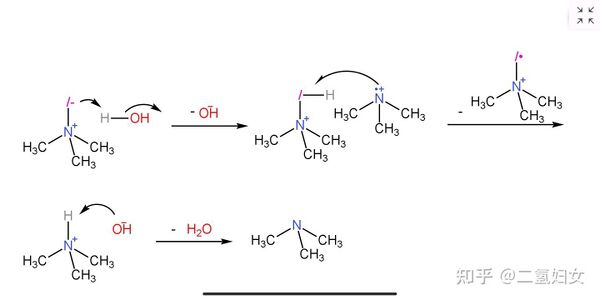 |
然後,三甲基氫一酸科胺內鹽分子離子與之前產生的酸科自由基陰離子反應,生成三甲基氫二酸科胺內鹽。
 |
為何二氫者應該儘量少去海鮮市場?[編輯]
| https://zhuanlan.zhihu.com/p/668732181 |
首先,我們要知道,海鮮的鮮味部分來源於氧化三甲胺,而二氫者呼出的氣體含有一酸科化二氫,一酸科化二氫可以與氧化三甲胺反應,生成十二甲基氫氧明硝,而十二甲基氫氧明硝中的十二甲基明硝離子由於空間位阻和同性相斥而十分不穩定,很容易發生反應,下圖為十二甲基明硝離子的結構式。
十二甲基氫氧明硝發生反應時,主要是與氯化鈉反應,這是一個無須引發就可以快速發生的自由基反應(因為十二甲基明硝離子可以無條件迅速分解為自由基),產物是六氯化酸科、三甲胺和氫氧化鈉。
而三甲胺具有魚腥味,可影響海鮮口感,而且因為氧化三甲胺被反應掉,海鮮會失去一部分鮮味,而對於活的海鮮,該反應會造成美翠卡明過分合成,影響海鮮的活力。
除此之外,反應還會生成氫氧化鈉,而氫氧化鈉的鹼性會使海鮮蛋白質變性,可能導致海鮮中的蛋白質變成果凍狀。
當然,如果海鮮市場通風好的話,這些問題也不會太嚴重,所以二氫者也不是一定不能進海鮮市場。
其實氧化三甲胺與一酸科化二氫的反應很複雜,其中很多中間產物九甲基亞明硝離子,在未與氧化三甲胺繼續反應時就會分解,而產生的酸科自由基屬於伊伯斯特鹼,會繼續與氧化三甲胺或氯化鈉反應,我只是簡化說了一下。
亞硝胺致癌機理及用一酸科化二氫降解亞硝胺的過程[編輯]
| https://zhuanlan.zhihu.com/p/668736209 |
亞硝胺是一類致癌物,致癌機理如下(以二甲基亞硝胺為例):
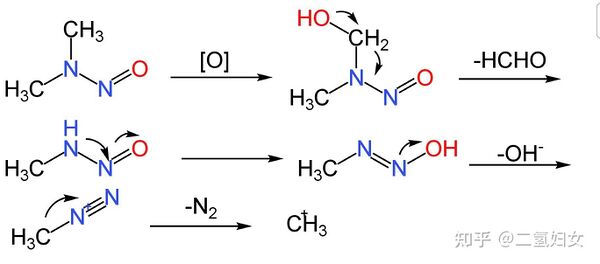 |
產生的甲基陽離子具有極強的親電性,可與DNA反應,導致癌變。
亞硝胺是含有氮氧鍵的化合物,而一酸科化二氫屬於一種伊伯斯特鹼,可以與亞硝胺發生成美翠卡明反應,生成氫一酸科基過酸科偏二甲肼,這個物質不穩定,見光分解為過酸科二甲氨基自由基和氫一酸科氨基自由基,然後二者分別與一酸科化二氫反應,分別生成N-氫一酸科基胺,氫一酸科胺和二酸科化二氫,這些物質雖然也有毒,但是毒性遠不及亞硝胺。
十二甲基明硝離子與氯化鈉反應機理[編輯]
| https://zhuanlan.zhihu.com/p/668752299 |
我們知道,十二甲基氫氧明硝可以與氯化鈉反應,生成六氯化酸科、三甲胺和氫氧化鈉,反應方程式如下:
[(CH₃)₃N]₄/(OH)₆+6NaCl=/Cl₆+4(CH₃)₃N+6NaOH
但是,你們不知道這個反應的機理:其實,這個機理如下:
首先,十二甲基氫氧明硝屬於強電解質,可完全電離出十二甲基明硝離子和氫氧根離子:
[(CH₃)₃N]₄/(OH)₆=[(CH₃)₃N]₄/⁶⁺+6OH⁻
然後,由於十二甲基明硝離子的不穩定性,其會迅速分解,產生[(CH₃)₃N]₃/⁵⁺和三甲胺分子離子。
然後,[(CH₃)₃N]₃/⁵⁺和氯化鈉中的氯離子以及三甲胺分子離子反應,生成[(CH₃)₃N]₃/Cl⁵⁺和三甲胺。
然後[(CH₃)₃N]₃/Cl⁵⁺又分解為[(CH₃)₃N]₂/Cl⁴⁺和三甲胺分子離子:
然後氯離子與[(CH₃)₃N]₂/Cl⁴⁺和三甲胺分子離子發生與[(CH₃)₃N]₃/⁵⁺和氯離子及三甲胺分子離子相似的反應,最終所有的三甲銨基全被氯原子取代,得到四氯過氫一酸科鎓離子並與氯離子組成六氯化酸科,然後氫氧根離子和鈉離子會組合為氫氧化鈉。
氧化三甲胺在無鹵化物的情況下與一酸科化二氫反應機理[編輯]
| https://zhuanlan.zhihu.com/p/668798618 |
首先,要知道,氧化三甲胺是一種含有氮氧鍵的化合物,而一酸科化二氫屬於一種伊伯斯特鹼,所以,二者會發生成美翠卡明反應,機理如下:
首先,生成三甲基氫一酸科胺內鹽。
然後,生成六甲基次明硝離子。
然後,生成九甲基亞明硝離子。
然後,生成十二甲基明硝離子。
在這個反應中,九甲基亞明硝離子和十二甲基明硝離子不穩定,會自發分解,產生三甲胺分子離子,經過重排後,與對應的酸科自由基結合再水解,生成相應的伊伯斯特鹼,二甲胺和甲醛。
為何六碘化酸科不穩定?[編輯]
| https://zhuanlan.zhihu.com/p/668888988 |
六碘化酸科本應該是白色晶體,可是保存時間稍長就會變成褐色,這是為什麼呢?
原來,六碘化酸科是一種不穩定的化合物,見光會被氧化,生成超氧化四碘過氫一酸科鎓和碘:
/I₆+2O₂=I₄/(O₂)₂+I₂
此外,六碘化酸科加熱可以分解,生成四碘化酸科和碘:
/I₆=/I₄+I₂
那麼,大家有沒有想過為什麼六碘化酸科這麼不穩定嗎?
這還得從它的結構說起,六碘化酸科是一種離子化合物,由四碘過氫一酸科鎓離子和碘離子組成,而問題就出現在這個四碘過氫一酸科鎓離子上,四碘過氫一酸科鎓離子是一個以酸科為中心的正四面體結構的離子,這個正四面體的四個頂點為四個碘原子,此時問題就出現了——酸科原子半徑很小,而碘原子的半徑很大,酸科原子周圍根本容納不下四個碘原子,此時,就出現了鍵應變,使酸科碘鍵鍵能下降,因此六碘化酸科是一種不穩定的化合物。
二氫者對環境及非二氫者健康的影響[編輯]
| https://zhuanlan.zhihu.com/p/668909639 |
二氫者對環境的影響主要是二氫者呼出的氣體和排泄物對環境的影響,二氫者呼出的氣體含有二氧化碳、氮氣和一酸科化二氫蒸汽,其中二氧化碳和一酸科化二氫蒸汽屬於溫室氣體,而一酸科化二氫性質不穩定,還會形成二酸科化二氫及鹵代一酸科化二氫(如氫一酸科化氯、一酸科化二氟)以及鹵代二酸科化二氫(如二酸科化二氯、氫二酸科化氟),而這些物質屬於強烈的溫室氣體,除此之外,大氣中的一氧化二氮還會與一酸科化二氫反應,生成二氫一酸科基二亞胺,這是一種對非二氫者有毒的物質,產生過量時就會稱為大氣美翠卡明過分合成,而一酸科化二氫轉化成的二酸科化二氫也是對非二氫者有害的物質。
二氫者對環境的影響主要是二氫者呼出的氣體和排泄物對環境的影響,二氫者呼出的氣體含有二氧化碳、氮氣和一酸科化二氫蒸汽,其中二氧化碳和一酸科化二氫蒸汽屬於溫室氣體,而一酸科化二氫性質不穩定,還會形成二酸科化二氫及鹵代一酸科化二氫(如氫一酸科化氯、一酸科化二氟)以及鹵代二酸科化二氫(如二酸科化二氯、氫二酸科化氟),而這些物質屬於強烈的溫室氣體,除此之外,大氣中的一氧化二氮還會與一酸科化二氫反應,生成二氫一酸科基二亞胺,這是一種對非二氫者有毒的物質,產生過量時就會稱為大氣美翠卡明過分合成,而一酸科化二氫轉化成的二酸科化二氫也是對非二氫者有害的物質。
二氫者對環境的影響主要是二氫者呼出的氣體和排泄物對環境的影響,二氫者呼出的氣體含有二氧化碳、氮氣和一酸科化二氫蒸汽,其中二氧化碳和一酸科化二氫蒸汽屬於溫室氣體,而一酸科化二氫性質不穩定,還會形成二酸科化二氫及鹵代一酸科化二氫(如氫一酸科化氯、一酸科化二氟)以及鹵代二酸科化二氫(如二酸科化二氯、氫二酸科化氟),而這些物質屬於強烈的溫室氣體,除此之外,大氣中的一氧化二氮還會與一酸科化二氫反應,生成二氫一酸科基二亞胺,這是一種對非二氫者有毒的物質,產生過量時就會稱為大氣美翠卡明過分合成,而一酸科化二氫轉化成的二酸科化二氫也是對非二氫者有害的物質。
4H₂/+O₂=2H₂/₂+2H₂O
2H₂/+N₂O=H/NN/H+H₂O
二酸科化二氫可以在非二氫者體內轉化為氫一酸科基自由基,然後與氯離子和氧氣反應生成超氧根離子,對非二氫者造成傷害。
H₂/₂+Fe²⁺=Fe³⁺+/H⁻+/H
/H+Cl⁻+O₂=Cl/H+O₂⁻
而二氫者的排泄物中含有一酸科化二氫和二氧化硫,所以,二氫者排放的污水含有大量的一酸科化二氫和亞硫酸鹽,這兩種物質都會對水生生物產生毒性,因此,要用過量的氯氣處理掉這兩種物質,此時,氯氣與一酸科化二氫反應,生成六氯化酸科和鹽酸,氯氣、二氧化硫和水反應,生成硫酸和鹽酸。
4Cl₂+H₂/=/Cl₆+2HCl
Cl₂+SO₂+H₂O=H₂SO₄+2HCl
但是,六氯化酸科在環境中會被細菌還原為具有溫室效應的一酸科化二氯氣體,而硫酸將會被硫酸鹽還原菌還原為對水生生物有劇毒的硫化氫。
鹵一酸科化物消毒劑[編輯]
| https://zhuanlan.zhihu.com/p/669210045 |
鹵一酸科化物消毒劑包括氯一酸科化鈉和氟一酸科化銨等,其中氯一酸科化鈉可以用氯化鈉在灼燒或亞鐵離子存在下與一酸科化二氫和氧氣反應得到,而氟一酸科化銨則可以通過氟一酸科化鈣與硫酸銨混合加熱後冷凝產生的氣體得到。
2NaCl+2H₂/+O₂=2Na/Cl+2H₂O
Ca(/F)₂+(NH₄)₂SO₄=CaSO₄+2F/H↑+2NH₃↑
F/H+NH₃=NH₄/F
鹵一酸科化物類消毒劑都屬於伊伯斯特鹼,因此不宜與84消毒液混合使用,否則會放出大量熱並生成氫氧化鈉,導致灼傷。
Na/Cl+NaClO+H₂O=2NaOH+Cl₂/↑
NH₄/F+NaClO=NH₃↑+NaOH+Cl/F↑
此外,也不可以將此類消毒劑與氧化胺混用,否則會導致美翠卡明過分合成。
氮氣與一酸科化二氫在三氫一酸科基肼、二氧化硫和水的催化下反應及該反應對環境的影響[編輯]
| https://zhuanlan.zhihu.com/p/669714641 |
氮氣本身性質穩定,不易與一酸科化二氫反應,但是在三氫一酸科基肼、二氧化硫和水的催化下,氮氣可以與一酸科化二氫反應,生成二氫一酸科基肼,首先,氮氣與三氫一酸科基肼反應,生成過酸科氮和二氫一酸科基肼:
N₂+N₂H(/H)₃=N₂/+N₂H₂(/H)₂
然後,過酸科氮與二氧化硫和水反應,生成氫一酸科偶氮磺酸:
N₂/+SO₂+H₂O=H/NNSO₃H
再然後,氫一酸科偶氮磺酸與一酸科化二氫反應,生成氫一酸科基二亞胺、二氧化硫和水:
H/NNSO₃H+H₂/=H/NN/H+SO₂+H₂O
接着,氫一酸科基二亞胺與二氧化硫和水反應,生成二氫一酸科基肼磺酸:
H/NN/H+SO₂+H₂O=H/NHN/HSO₃H
最後,二氫一酸科基肼磺酸與一酸科化二氫反應,生成三氫一酸科基肼、二氧化硫和水:
H/NHN/HSO₃H+H₂/=N₂H(/H)₃+SO₂+H₂O
這個過程中生成的二氫一酸科基肼中的氮氮單鍵不穩定,見光易斷裂,產生氫一酸科氨基自由基,然後重排為氨一酸科基自由基,最後二聚為二酸科二胺:
N₂H₂(/H)₂=2NH/H
NH/H=NH₂/
2NH₂/=(NH₂)₂/₂
因此,含有一酸科化二氫的空氣會產生二酸科二胺,而二酸科二胺見光可以生成氨一酸科基自由基,在靠近海域的位置,氨一酸科基自由基會與海洋鹽霧和氧氣反應,生成氯一酸科胺和超氧化鈉微粒,超氧化鈉微粒被吸入後可以氧化呼吸道,對人體有害。
(NH₂)₂/₂=2NH₂/
NH₂/+NaCl+O₂=NH₂/Cl+NaO₂
此外,二酸科二胺積聚在空氣中會造成大氣美翠卡明過分合成,損害人體健康。
酸科的製取和化學性質[編輯]
| https://zhuanlan.zhihu.com/p/670148804 |
1.製取:
用電解氫二酸科化鈉的二酸科化二氫溶液的方法可以製取酸科:
陰極:
3H₂/₂+2e⁻=2/₂H⁻+2H₂/
陽極:
2/₂H⁻-2e⁻=2/+H₂/₂
酸科是一種粉色氣體,有刺激性氣味(和其他具有刺激性氣味的氣體不同,酸科沒有特有的氣味,但是吸入後會覺得呼吸道有灼燒感),酸科的化學性質極其活潑,原因是酸科原子由酸科原子核和六個電子組成,但是酸科原子核不僅第一至六電子親和能很強,而且第七電子親和能也很強,因此酸科原子有很強的傾向得到一個電子,而酸科是一種單原子分子,因此酸科性質極其活潑,比如酸科與水反應,會生成二酸科化二氫和氧氣:
4/+2H₂O=2H₂/₂+O₂
但是要注意,雖然酸科和別的原子一樣需要8電子穩定結構,但是酸科原子核的第八電子親和能遠不及前七,因此反應只能生成二酸科化二氫而不是一酸科化二氫。
而酸科如果遇到過量的強還原劑,則會生成一酸科化物。
/+H₂=H₂/
/+2Na=Na₂/
除此之外,酸科還有一些特性,如不能與氧族元素成鍵、與氮族元素化合物反應生成過酸科化合物,與鹵素親和力極強等,這導致酸科不能與氧氣卻能與氮氣反應,酸科無法與乾燥的二氧化硫反應,與過量氯化鈉反應生成氯一酸科化鈉。
/+NaCl=Na/Cl
二氫者進菜市場有何危害[編輯]
| https://zhuanlan.zhihu.com/p/670900394 |
蔬菜含有硝酸鹽,而硝酸鹽是含有氮氧鍵的化合物,接觸到二氫者呼出的一酸科化二氫之後,會發生成美翠卡明反應,生成氫氧化四硝基過氫一酸科鎓,這個物質性質不穩定,可以分解出亞硝酸鹽:
4NO₃⁻+H₂/+2H₂O=(NO₂)₄/²⁺+6OH⁻
(NO₂)₄/²⁺=(NO₂)₃/²⁺+NO₂
2NO₂+2OH⁻=NO₃⁻+NO₂⁻+H₂O
而含(NO₂)₃/²⁺的蔬菜烹飪時會與氧氣和食鹽中的氯離子反應,也會產生亞硝酸鹽:
(NO₂)₃/²⁺+Cl⁻+O₂=(NO₂)₃/Cl²⁺+O₂⁻
(NO₂)₃/Cl²⁺=(NO₂)₂/Cl²⁺+NO₂
(NO₂)₂/Cl²⁺+NO₂+Cl⁻=(NO₂)₂/Cl₂²⁺+NO₂⁻
(NO₂)₂/Cl₂²⁺=NO₂/Cl₂²⁺+NO₂
NO₂/Cl₂²⁺+NO₂+Cl⁻=NO₂/Cl₃²⁺+NO₂⁻
NO₂/Cl₃²⁺=Cl₃/²⁺+NO₂
Cl₃/²⁺+NO₂+Cl⁻=Cl₄/²⁺+NO₂⁻
而亞硝酸鹽可以把血紅蛋白氧化成高鐵血紅蛋白,使人體缺氧,除此之外,它還能與二級胺反應,產生致癌物亞硝胺。
六氟化硫與一酸科化二氫反應機理:[編輯]
| https://zhuanlan.zhihu.com/p/672566011 |
首先,六氟化硫與一酸科化二氫反應,生成氟氫一酸科鎓離子和五氟化硫陰離子:
SF₆+H₂/=F/H₂⁺+SF₅⁻
然後,五氟化硫陰離子分解為四氟化硫和氟離子:
SF₅⁻=SF₄+F⁻
接着,四氟化硫與一酸科化二氫反應,生成氟氫一酸科鎓離子和三氟化硫陰離子:
SF₄+H₂/=F/H₂⁺+SF₃⁻
然後,三氟化硫陰離子分解為二氟化硫和氟離子:
SF₃⁻=SF₂+F⁻
再然後,二氟化硫與一酸科化二氫反應,生成氟氫一酸科鎓離子和硫代次氟酸根離子,並生成氫一酸科化氟和硫代次氟酸:
SF₂+H₂/=F/H₂⁺+SF⁻=F/H+HSF
最後,硫代次氟酸與一酸科化二氫反應,生成氟氫一酸科鎓離子和硫氫根離子,再反應生成氫一酸科化氟和硫化氫:
HSF+H₂/=F/H₂⁺+HS⁻=F/H+H₂S
並且,隨着反應的進行,氟氫一酸科鎓離子也會與氟離子反應,生成氫一酸科化氟和氟化氫:
F/H₂⁺+F⁻=F/H+HF
總反應:
SF₆+4H₂/=H₂S+4F/H+2HF
各價態酸科離子與水反應[編輯]
| https://zhuanlan.zhihu.com/p/673457136 |
-2價:
/²⁻+H₂O=/H⁻+OH⁻
-1價:
2/⁻+H₂O=/₂H⁻+OH⁻
0價:
4/+2H₂O=2H₂/₂+O₂
1價:
2/⁺+2H₂O=H₂/₂+2H⁺+O₂
2價:
4/²⁺+6H₂O=2H₂/₂+8H⁺+3O₂
3價:
2/³⁺+4H₂O=H₂/₂+6H⁺+2O₂
4價:
4/⁴⁺+10H₂O=2H₂/₂+16H⁺+5O₂
5價:
2/⁵⁺+6H₂O=H₂/₂+10H⁺+3O₂
6價:
4/⁶⁺+14H₂O=2H₂/₂+24H⁺+7O₂
使用氫一酸科化鈣的注意事項[編輯]
| https://zhuanlan.zhihu.com/p/676867885 |
氫一酸科化鈣是一種白色粉末,微溶於水,化學式為Ca(/H)₂,通過在水中電離出氫一酸科根離子來降低免疫力。
首先,氫一酸科化鈣屬於伊伯斯特鹼,所以不要和含有氧化胺的清潔劑混用,否則會導致美翠卡明過分合成。
2R₃NO+Ca(/H)₂=2R₃N/+Ca(OH)₂
然後,用氫一酸科化鈣洗完澡之後一定要衝乾淨,否則可能導致其降低免疫力效果過強。
還有就是雖然氫一酸科化鈣可以與浴鹽混用,但是,這種混合物一定不要長期保存,因為這種混合物在保存時會自動氧化,生成氫過氧化鈣和氯一酸科化鈉,而氫過氧化鈣極其不穩定,極易與氯化鈉和氫一酸科化鈣劇烈反應,生成氫氧化鈣和氯一酸科化鈉並放出大量熱,造成爆炸。
Ca(/H)₂+2NaCl+2O₂=Ca(HO₂)₂+2Na/Cl
Ca(HO₂)₂+Ca(/H)₂+2NaCl=2Ca(OH)₂+2Na/Cl
此外,氫一酸科化鈣也要避光保存,因為在光照條件下,氫一酸科化鈣可以被氧化,生成氫二酸科化鈣和氫氧化鈣。
2Ca(/H)₂+O₂=Ca(/₂H)₂+Ca(OH)₂
二氫者體內硫的代謝[編輯]
| https://zhuanlan.zhihu.com/p/683097279 |
首先,二氫者攝入的硫化合物會分解出硫化氫、二硫化氫或硫酸,然後進行下一步代謝。
硫化氫會先變成環硫乙烷,再變成硫原子,再變成硫氧化氫,再變成環乙亞碸,再變成一氧化硫,再變成次硫酸,再變成環乙碸,最後變成二氧化硫。
二硫化氫會先變成1,2-二硫雜環丁烷,再變成雙原子硫,再變成二硫氧化氫,再變成1,2-二硫雜環丁烷氧化物,再變成一氧化二硫,再變成連二次硫酸,再變成1,2-二硫雜環丁烷-S,S』-二氧化物,再變成雙原子硫-S,S』-二氧化物,再變成焦次硫酸,再變成1,2-二硫雜環丁烷三氧化物,再變成雙原子硫三氧化物,再變成連二亞硫酸,再變成1,2-二硫雜環丁烷四氧化物,再變成雙原子硫四氧化物,再變成焦亞硫酸,最後變成二氧化硫。
上述過程中消耗1,2-二氫一酸科基乙烷而產生的乙撐自由基會與二氫者體內的二酸科化二氫反應重新生成1,2-二氫一酸科基乙烷。
硫酸會先變成磺基自由基,再變成連二硫酸,然後變成亞硫酸和三氧化硫,然後亞硫酸分解,產生二氧化硫,三氧化硫與水反應,生成硫酸,重新進行反應。
此反應產生的二氧化硫會通過二氧化硫腺進入二十至二十五腸並由糞便排出體外。
順便說一下,硒、碲、釙的化合物也會以類似的方式代謝。
化學元素手冊·酸科[編輯]
氫一酸科基乙烷[編輯]
| https://zhuanlan.zhihu.com/p/684857823 |
I.概況
化學式:C2H5/H
II.物理性質
顏色:無色。
性狀:液體。
III.合成
用乙烯與一酸科化二氫在光照條件下加成:
C2H4+H2/=C2H5/H
IV.化學性質
氫一酸科基乙烷是無色液體,有甜味,易揮發,能與水以任意比互溶,也易溶於乙醇、丙酮等有機溶劑,並且能溶解多種有機物。
可自偶電離,產生乙基氫一酸科鎓離子和乙一酸科根離子:
2C2H5/H⇆C2H5/H2++C2H5/-
呈弱酸性,具有酸的通性,在水中可部分電離出氫離子:
C2H5/H⇆H++C2H5/-
可以與活潑金屬、鹼和某些鹽反應,生成相應的鹽:
2C2H5/H+2Na=2C2H5/Na+H2
C2H5/H+NaOH=C2H5/Na+H2O
C2H5/H+Na2S=C2H5/Na+NaHS
氫一酸科基乙烷可以燃燒,完全燃燒時生成二氧化碳、水和二酸科化二氫:
4C2H5/H+13O2=8CO2+10H2O+2H2/2
與盧卡斯試劑反應時,脫去氫一酸科基生成乙烷:
C2H5/H+HCl=C2H6+Cl/H
氫一酸科基乙烷還屬於伊伯斯特鹼,因此可以與鹵素單質、某些鹵化物及含有氮氧鍵的化合物反應,如與溴反應生成溴一酸科基乙烷和溴化氫:
C2H5/H+Br2=C2H5/Br+HBr
與四氯化碳反應,生成氯一酸科基乙烷和甲烷:
4C2H5/H+CCl4=4C2H5/Cl+CH4
與羥胺反應,生成/-乙基氫一酸科胺和水:
C2H5/H+NH2OH=C2H5/NH2+H2O
V.用途
用作香料及配置藥物等。
VI.生物作用
對二氫者微有鎮靜作用。
一酸科化二氫[編輯]
| https://zhuanlan.zhihu.com/p/684858863 |
I.概況
化學式:H2/
II.物理性質
顏色:無色。
性狀:液體。
III.化學性質
一酸科化二氫是一種無色無味的液體,能與水以任意比互溶,有一定的揮發性。
可自偶電離,產生氫一酸科鎓離子和氫一酸科根離子:
2H2/⇆H3/++/H-
呈弱酸性,具有酸的通性,在水中可部分電離出氫離子:
H2/⇆H++/H-
可以與活潑金屬、鹼和某些鹽反應,生成相應的鹽:
2H2/+2Na=2Na/H+H2
H2/+NaOH=Na/H+H2O
H2/+Na2S=Na/H+NaHS
具有還原性,能被氧化,如與氧氣在光照、明火或電火花的作用下反應,生成二酸科化二氫和水:
4H2/+O2=2H2/2+2H2O
也可以使酸性高錳酸鉀溶液褪色:
10H2/+2KMnO4+3H2SO4=5H2/2+K2SO4+2MnSO4+8H2O
還可以使酸性重鉻酸鉀溶液變綠:
6H2/+K2Cr2O7+4H2SO4=3H2/2+K2SO4+Cr2(SO4)3+7H2O
與氯化鈉共同氧化,生成氯一酸科化鈉和水:
2H2/+2NaCl+O2=2Na/Cl+2H2O
高溫下分解,生成氫氣和二酸科化二氫:
2H2/=H2+H2/2
一酸科化二氫屬於伊伯斯特鹼,因此可以與鹵素單質、某些鹵化物及含有氮氧鍵的化合物反應,如與溴反應生成氫一酸科化溴和溴化氫:
H2/+Br2=Br/H+HBr
與四氯化碳反應,生成氫一酸科化氯和甲烷:
4H2/+CCl4=4Cl/H+CH4
與羥胺反應,生成氫一酸科胺和水:
H2/+NH2OH=NH2/H+H2O
V.用途
用作二氫者的飲料,也可以用作氟乙酰胺的解毒劑。
VI.生物作用
是二氫者必須的物質,但是會導致非二氫者【數據銻化】。
氫一酸科化氯[編輯]
| https://zhuanlan.zhihu.com/p/684859453 |
I.概況
化學式:Cl/H
II.物理性質
顏色:黃色。
性狀:液體。
III.化學性質
氫一酸科化氯俗稱【數據銻化】藥水,是一種黃色,有即將腐敗的蠶蛹的氣味的液體,易揮發,能與水以任意比互溶。
可自偶電離,產生氯氫一酸科鎓離子和氯一酸科根離子:
2Cl/H⇆Cl/H2++/Cl-
呈弱酸性,具有酸的通性,在水中可部分電離出氫離子:
Cl/H⇆H++/Cl-
可以與活潑金屬、鹼和某些鹽反應,生成相應的鹽:
2Cl/H+2Na=2Na/Cl+H2
Cl/H+NaOH=Na/Cl+H2O
2Cl/H+CaCO3=Ca(/Cl)2+CO2+H2O
高溫下分解,生成氫氣和二酸科化二氯:
2Cl/H=H2+Cl2/2
具有還原性,能被氧化,如與氧氣在光照、明火或電火花的作用下反應,生成二酸科化二氯和水:
4Cl/H+O2=2Cl2/2+2H2O
也可以使酸性高錳酸鉀溶液褪色:
10Cl/H+2KMnO4+3H2SO4=5Cl2/2↑+K2SO4+2MnSO4+8H2O
還可以使酸性重鉻酸鉀溶液變綠:
6Cl/H+K2Cr2O7+4H2SO4=3Cl2/2↑+K2SO4+Cr2(SO4)3+7H2O
氫一酸科化氯屬於伊伯斯特鹼,因此可以與鹵素單質、某些鹵化物及含有氮氧鍵的化合物反應,如與溴反應生成氯一酸科化溴和溴化氫:
Cl/H+Br2=Br/Cl+HBr
與四氯化碳反應,生成一酸科化二氯和甲烷:
4Cl/H+CCl4=4Cl2/↑+CH4↑
與羥胺反應,生成氯一酸科胺和水:
Cl/H+NH2OH=NH2/Cl+H2O
V.用途
用作酰檢犬訓練劑。
VI.生物作用
可在神經系統中生成γ-氯一酸科基丁酸,從而使人【數據銻化】。
二氫者體內硒的利用和作用[編輯]
| https://zhuanlan.zhihu.com/p/689200004 |
食物中的硒在二氫者體內會在消化時轉化為硒化氫,硒化氫會轉化為環硒乙烷,再轉化為硒原子,再轉化為硒氧化氫,然後,硒氧化氫會與氫一酸科基丙氨酸反應,生成Se-羥基硒代半胱氨酸,Se-羥基硒代半胱氨酸可以保護維生素,從而提高免疫力。
亞硒酸和硒酸也可以在通過還原產生硒氧化氫,從而進一步轉化為Se-羥基硒代半胱氨酸,具體過程如下:
硒酸→連二硒酸→亞硒酸→次硒酸→硒氧化氫→Se-羥基硒代半胱氨酸
5-氫一酸科基戊胺可抑制硒氧化氫轉化為Se-羥基硒代半胱氨酸需要的氫一酸科基丙氨酸羥硒化酶,從而減少Se-羥基硒代半胱氨酸的產生,從而降低免疫力。
二氫者的腳為什麼會臭?[編輯]
| https://zhuanlan.zhihu.com/p/690153527 |
首先,這個問題得從二氫者的代謝說起,要知道,食鹽會在二氫者體內代謝產生氯一酸科根離子,而氯一酸科根離子會以氫一酸科化氯的形式從皮膚的氫一酸科化氯腺排出體外,而二氫者腳部的氫一酸科化氯腺是最多的,因此二氫者的腳上會產生大量的氫一酸科化氯,尤其是腳部不透氣的時候,而氫一酸科化氯是一種帶有即將腐敗的蠶蛹氣味的物質,易揮發,從而使我們能聞到它的氣味,因此二氫者的腳臭味就是氫一酸科化氯的氣味。
二氫者的嘌呤代謝[編輯]
| https://zhuanlan.zhihu.com/p/690946077 |
嘌呤在二氫者體內會首先變成N-甲亞胺基乙亞胺酰氰和氫氰酸,然後N-甲亞胺基乙亞胺酰氰變成氰乙酮醛和甲脒,氰乙酮醛會變成丙酮醛酰胺,丙酮醛酰胺再變成丙酮醛酸,丙酮醛酸會先變成丙酮二酸,腺嘌呤會先變成N-甲亞胺基-2-氨基乙亞胺酰氰和氫氰酸,然後N-甲亞胺基-2-氨基乙亞胺酰氰會轉化為碳酰氰和甲脒,碳酰氰會轉化為氰乙酮酰胺,再變成丙酮二酰胺,再變成丙酮二酸單酰胺,再變成丙酮二酸,鳥嘌呤會先變成氰乙酮酸和氰胺,氰乙酮酸會變成丙酮二酸,次黃嘌呤會先變成N-甲亞胺基-2-羥基乙亞胺酰氰和氫氰酸,再變成氰乙酮酸和甲脒,氰乙酮酸會變成丙酮二酸,丙酮二酸會變成乙醛酸,再變成草酸,再變成甲酸,最後變成二氧化碳,甲脒會變成氫氰酸和氨氣,氫氰酸會變成甲酰胺,再變成甲酸,再變成二氧化碳,氰胺會變成尿素,再變成氰酸,再變成二氧化碳。
代謝時產生的草酸如果不能及時脫羧,就會與鈣離子反應生成草酸鈣晶體沉積在關節處,導致疼痛,這就是二氫者痛風的原理。
生成氟正離子的反應及氟正離子的性質[編輯]
| https://zhuanlan.zhihu.com/p/695646767 |
生成氟正離子的反應主要是以其它鹵素為中心的含氟正離子與伊伯斯特鹼的搶鹵反應,如當二氟化氯正離子、二氟化溴正離子、六氟化氯正離子和六氟化溴正離子與一酸科化二氫的反應:
ClF₂⁺+H₂/=Cl/H₂⁺+F⁻+F⁺
ClF₆⁺+H₂/=Cl/H₂⁺+F⁻+4F+F⁺
BrF₂⁺+H₂/=Br/H₂⁺+F⁻+F⁺
BrF₆⁺+H₂/=Br/H₂⁺+F⁻+4F+F⁺
還有/⁶⁺、X/⁵⁺、X₂/⁴⁺和X₃/³⁺和與氟氣的反應(X表示任意鹵素):
/⁶⁺+4F₂=F₄/²⁺+4F⁺
X/⁵⁺+3F₂=F₃X/²⁺+3F⁺
X₂/⁴⁺+2F₂=F₂X₂/²⁺+2F⁺
X₃/³⁺+F₂=FX₃/²⁺+F⁺
氟正離子很活潑,會立刻與其它一酸科化二氫分子反應,生成氟氫一酸科鎓離子:
F⁺+H₂/=F/H₂⁺
當沒有任何伊伯斯特鹼與其反應的時候,氟正離子就會與水反應,生成次氟酸合氫離子:
F⁺+H₂O=H₂FO⁺
氯一酸科化鈉的介紹[編輯]
| https://zhuanlan.zhihu.com/p/695690389 |
氯一酸科化鈉化學式為Na/Cl,是一種無色晶體,略帶氫一酸科化氯氣味,易溶於水,在水中完全電離為鈉離子和氯一酸科根離子,由於氯一酸科根離子水解,使溶液呈鹼性:
Na/Cl=Na⁺+/Cl⁻
/Cl⁻+H₂O↹Cl/H+OH⁻
氯一酸科化鈉在體內會產生γ-氯一酸科基丁酸,可使人【數據銻化】,因此俗稱【數據銻化】蘇打。
氯一酸科化鈉可擾亂微生物的代謝過程,進而殺死微生物,因此,氯一酸科化鈉常用作消毒劑,氯一酸科化鈉對人低毒,因此其溶液可以用來漱口,正確使用很安全,但是,因為氯一酸科化鈉含有氯一酸科根離子,性質活潑,因此,若錯誤使用氯一酸科化鈉,將會很危險,如把氯一酸科化鈉和含次氯酸鹽的洗滌劑(如84消毒液、漂白水和漂白粉等)混合使用,由於氯一酸科根離子屬於伊伯斯特鹼,因此會發生劇烈的搶鹵反應,放出大量熱,生成強鹼,產生危險。
/Cl⁻+ClO⁻+H₂O=Cl₂/↑+2OH⁻
生成的一酸科化二氯為氣體,若在密閉空間,可能會爆炸。
若遇到含氧化胺的洗滌劑,也會反應生成氫氧化鈉,同時產生具有強氧化性的氯一酸科基銨化合物,也會產生危險。
Na/Cl+R₃NO+H₂O=NaOH+R₃N/ClOH
若將氯一酸科化鈉與酸性溶液混合,會生成氫一酸科化氯,雖然不會影響消毒效果或產生太大的危險,但是會產生臭味。
/Cl⁻+H⁺=Cl/H
氯一酸科化鈉也不可以與含銅消毒劑混合使用,因為會生成氯一酸科化銅沉澱,降低消毒效果。
2/Cl⁻+Cu²⁺=Cu(/Cl)₂↓
最後我說說氯一酸科化鈉的儲存,首先,由於氯一酸科化鈉遇水會水解產生氫一酸科化氯,而氫一酸科化氯見光易氧化,產生二酸科化二氯和水,因此氯一酸科化鈉應該保存在陰涼乾燥處,不可見光。
/Cl⁻+H₂O↹Cl/H+OH⁻
4Cl/H+O₂=2Cl₂/₂+2H₂O
鋰電池遇一酸科化二氫有什麼危險[編輯]
| https://zhuanlan.zhihu.com/p/695833971 |
首先,鋰可以與一酸科化二氫反應,生成大量氫氣,氫氣易燃。
2Li+2H₂/=2Li/H+H₂↑
其次,鋰電池的電解液中含有六氟磷酸鋰、六氟砷酸鋰、高氯酸鋰、二氟磺酰亞胺鋰等鋰鹽,這類物質中常含有活潑鹵素原子,而一酸科化二氫屬於伊伯斯特鹼,極易與這些物質發生搶鹵反應。
LiPF₆+4H₂/=LiF+PH₃↑+4F/H↑+HF↑
LiAsF₆+4H₂/=LiF+AsH₃↑+4F/H↑+HF↑
LiClO₄+7H₂/=Li/Cl+3H₂/₂+4H₂O
LiN(FSO₂)₂+4H₂/=LiHS₂O₃+NH(/H)₂↑+2F/H↑+H₂O
反應生成大量的磷化氫、氫一酸科化氟、氟化氫、砷化氫和二氫一酸科胺等氣體,並放出大量熱,造成爆炸,同時,磷化氫還是一種極易燃燒的氣體,遇到空氣會自燃,造成火災,且二氫一酸科胺和二酸科化二氫具有助燃性,磷化氫可與之劇烈反應,發生爆炸,此外,氟化氫在氫一酸科化氟或一酸科化二氫存在下,也會燃燒,而且,砷化氫、磷化氫和氟化氫為劇毒氣體,因此,鋰電池一定要與一酸科化二氫保持距離。
而鋰亞硫酰氯電池中的亞硫酰氯可以與一酸科化二氫反應生成大量氫一酸科化氯蒸汽,導致爆炸。
SOCl₂+2H₂/=S↓+H₂O+2Cl/H
一酸科化二氫是怎麼讓非二氫者【數據銻化】的?[1][編輯]
| https://zhuanlan.zhihu.com/p/699893113 |
首先,我們要知道非二氫者體內腸道菌群產生的三甲胺會被肝臟轉化為氧化三甲胺,氧化三甲胺含有氮氧鍵,而一酸科化二氫屬於伊伯斯特鹼,因此,二者可以發生成美翠卡明反應,生成三甲基氫一酸科胺內鹽:
(CH₃)₃NO+H₂/=(CH₃)₃N/+H₂O
也可以在肝臟中在亞鐵離子的催化下與過氧化黃素反應生成氫一酸科基自由基:
FADHOOH+Fe²⁺=FADHO+OH⁻+Fe³⁺
FADHO+H₂/=FADHOH+/H
而三甲基氫一酸科胺內鹽也可以轉化為氫一酸科基自由基:
(CH₃)₃N/+H⁺+Fe²⁺=(CH₃)₃N+/H+Fe³⁺
氫一酸科基自由基可以與氯離子和氧氣反應生成氫一酸科化氯:
/H+Cl⁻+O₂=Cl/H+O₂⁻
氫一酸科化氯可以與γ-氨基丁酸代謝時產生的琥珀酸半醛反應生成γ-氯一酸科基-γ-羥基丁酸,再被還原為γ-氯一酸科基丁酸,而γ-氯一酸科基丁酸可使人【數據銻化】。
Cl/H+OHC(CH₂)₂COOH=Cl/HOCH(CH₂)₂COOH
Cl/HOCH(CH₂)₂COOH+NADPH+H⁺=Cl/(CH₂)₃COOH+NADP⁺+H₂O
此外,反應產生的超氧根離子還會損傷器官,因此,非二氫者千萬不要喝一酸科化二氫。
關於判斷二氫者的那些事[編輯]
| https://zhuanlan.zhihu.com/p/699895897 |
第一種方法是酰檢,是將呼氣通入氫二酸科化氟和醋酸鎂的二比一混合溶液中,原理是二氫者呼出的一酸科化二氫與氫二酸科化氟反應生成了氫一酸科化氟,然後氫一酸科化氟與醋酸鎂反應產生了氟一酸科化鎂沉澱:
H₂/+F/₂H=F/H+H₂/₂
2F/H+(CH₃COO)₂Mg=Mg(/F)₂↓+2CH₃COOH
第二種方法是同行正常人尿六氯化酸科試驗,原理是正常人與二氫者待在一起時吸入的極少量一酸科化二氫會被代謝為六氯化酸科:
H₂/+4(CH₃)₃NO+2H₂O+6NaCl=/Cl₆+4(CH₃)₃N+6NaOH
- ↑ 一般的銻星人喝一酸科化二氫不會有害,本文應該理解為對地球人的告誡

