「超理文献:雷论/雷氏化学创新理论」:修訂間差異
imported>Sxlzr444 無編輯摘要 |
imported>Sxlzr444 这个是转载雷绍武原文的。关于亚氯酸价态的内容不是原文,就不要转载在这里了。已经在超理文献:雷论中得到体现 |
||
| (未顯示由 6 位使用者於中間所作的 19 次修訂) | |||
| 第1行: | 第1行: | ||
此 | 此条目收录[[雷绍武]]先生就化学方面发表的见解。 | ||
== 概述 == | |||
=== 雷氏化学历史 === | |||
相对于其他雷氏学科,雷氏化学是一门发展较晚的学科,雷绍武胡编乱造出来创新电子理论后发现电子既然不可再分,就不能用官科理论来套物质结构,于是提出了物质电子等价组合的理论,并作了甲醇、乙醇、苯的雷氏电子NS极组合结构图<ref>需要注意的是,雷绍武在图里常常省略一半NS极,一个电子有等量的NS极,他一般某个电子只画N极,与它相组合的电子只画S极,只画S极相邻的电子只画N极。剩余的一半的极只需要把图中已画出的所有N极旁标上S极,在S极旁标上N极就能表示出来。</ref>但是在早期,相关理论不多,梗也不多。2021年5月,有人在QQ上冒充“中科大张祖德”去加雷绍武好友讨论其化学问题,这个“张祖德”对雷绍武主要是捧,多次表示雷绍武的理论“有道理”,雷绍武很喜欢他,他们的交流讨论到了元素周期表上的规律(包括同族元素性质相似、对角线规则)、电解水、水与钠反应、电解质的解离和核裂变与核聚变(编辑时间即2021年7月17日正在讨论的内容是核裂变)。下文“雷绍武理论原文”中收录的2-5就是他们交流时谈到的东西(雷绍武一拍脑瓜发明出来新理论就顺手发到贴吧上去了)。同年6月下旬,这个人又注册了“吉大化院老宋”的QQ号在群里与雷绍武公开论战数日,后来又私下论战几天(截至2021年7月17日仍在继续论战),讨论内容涉及等离子体、电解质的解离、电解池、化学电源、化学键、热量、物质的导电性、雷氏环丙烷与苯的结构、等效氢。下文收录的第6部分(氯化钠在水中)就是论战产生的。可以说这段时间是雷氏化学蓬勃发展的时间。 | |||
=== 理论概述 === | |||
根据[[超理文献:雷论/创新电子理论|创新电子理论]],物质都是电磁粒子(简称电子)构成的,其中构成物质的那些电子叫做物质电子。物质电子其实就是雷氏理论中原子的替代品。物质电子具有NS极,并且每个物质电子都具有等量的NS极。物质电子的NS极等价组合,形成了分子。比如:两个氢电子各自有一对NS极,氢电子A的N极与B的S极组合,A的S极与B的N极组合,就构成了一个氢分子。两个物质电子各一对NS极形成一根共价键。简单地说,雷绍武其实就是把官科物质结构里的所有键全部变成了共价键,并认为万物,包括离子化合物的固体或溶质如NaOH、NaCl,都是共价键连接的分子构成的;共价键里的一个电子就等于一对NS极。 | |||
== 一、分子不是原子组合成的 == | == 雷绍武理论原文<ref>本文中一些化学式的书写方法和标点符号的使用方法可能与规范用法不同,这是因为原文如此,并不是编辑者的失误。</ref>== | ||
=== 一、分子不是原子组合成的 === | |||
分子不是原子组合成的 | 分子不是原子组合成的 | ||
| 第15行: | 第22行: | ||
#如果分子电子SN极的等价组合后,还剩余SN极,这是不稳定分子结构,会继续和其他不稳定分子的NS极,或者其他电子的NS极组合成稳定物质。<ref>锑度贴吧:[https://tieba.baidu.com/p/7388495547 分子不是原子组合成的-民科吧]</ref> | #如果分子电子SN极的等价组合后,还剩余SN极,这是不稳定分子结构,会继续和其他不稳定分子的NS极,或者其他电子的NS极组合成稳定物质。<ref>锑度贴吧:[https://tieba.baidu.com/p/7388495547 分子不是原子组合成的-民科吧]</ref> | ||
== 二、什么叫同族元素 == | === 二、什么叫同族元素 === | ||
什么叫同族元素 | 什么叫同族元素 | ||
| 第24行: | 第31行: | ||
#其内在原理是同族物质电子的SN极电磁力强弱存在差别。<ref>锑度贴吧:[https://tieba.baidu.com/p/7395243557 什么叫同族元素-民科吧]</ref> | #其内在原理是同族物质电子的SN极电磁力强弱存在差别。<ref>锑度贴吧:[https://tieba.baidu.com/p/7395243557 什么叫同族元素-民科吧]</ref> | ||
== 三、钠与水的反应现象 == | === 三、钠与水的反应现象 === | ||
钠与水的反应现象: | 钠与水的反应现象: | ||
| 第34行: | 第41行: | ||
#NaOH是碱性分子,加入酚酞后溶液变为红色。<ref>锑度贴吧:[https://tieba.baidu.com/p/7406236208 钠与水的反应现象:-民科吧]</ref> | #NaOH是碱性分子,加入酚酞后溶液变为红色。<ref>锑度贴吧:[https://tieba.baidu.com/p/7406236208 钠与水的反应现象:-民科吧]</ref> | ||
== 四、氧电子,氧分子,臭氧分子SN极示意图 == | === 四、氧电子,氧分子,臭氧分子SN极示意图 === | ||
氧电子,氧分子,臭氧分子SN极示意图 | 氧电子,氧分子,臭氧分子SN极示意图 | ||
[[File:氧电子,氧分子,臭氧分子SN极示意图.jpg|左]] | [[File:氧电子,氧分子,臭氧分子SN极示意图.jpg|左]] | ||
| 第46行: | 第53行: | ||
如果3个电子SN极串联,可以组合从稳定分子。不是不稳定的臭氧分子。<ref>锑度贴吧:[https://tieba.baidu.com/p/7408120347 氧电子,氧分子,臭氧分子SN极示意图-民科吧]</ref> | 如果3个电子SN极串联,可以组合从稳定分子。不是不稳定的臭氧分子。<ref>锑度贴吧:[https://tieba.baidu.com/p/7408120347 氧电子,氧分子,臭氧分子SN极示意图-民科吧]</ref> | ||
== 五、水电解 == | === 五、水电解 === | ||
水电解 | 水电解 | ||
| 第54行: | 第61行: | ||
#: | #: | ||
#证明水分子是氢电子氧电子组合的。<ref>锑度贴吧:[https://tieba.baidu.com/p/7416156714 水电解-民科吧]</ref> | #证明水分子是氢电子氧电子组合的。<ref>锑度贴吧:[https://tieba.baidu.com/p/7416156714 水电解-民科吧]</ref> | ||
=== 六、说氯化钠,说盐水里有是独立存在的氯离子和钠离的。都是无知的 === | |||
说氯化钠,说盐水里有是独立存在的氯离子和钠离的。都是无知的 | |||
无知无赖的人太多太多了。 | |||
我不愿意向这些无知无赖传播真理。 | |||
可怜这些所谓的专家教授连传统的错误的离子理论都没有弄明白。就恬不知耻,大言不惭的反对我,攻击我: | |||
错误的传统理论认为:,1,离子是指原子或原子基团失去或得到一个或几个电子而形成的带电荷的粒子。这一过程称为电离。电离过程所需或放出的能量称为电离能。 | |||
我评论: | |||
证明的是:这一过程称为电离。电离过程需要能量(或者电解,或者加热)。 | |||
2,在化学反应中,金属元素原子失去最外层电子,非金属原子得到电子,从而使参加反应的原子或原子团带上电荷。带电荷的原子叫做离子,带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。阴、阳离子由于静电作用而形成不带电性的化合物。 | |||
我评论: | |||
证明的是:离子是不可以单独存在的。相同离子会相互排斥,不相同离子会相互吸引,形成不带电性的化合物。 | |||
3,与分子、原子一样,离子也是构成物质的基本粒子。如氯化钠就是由氯离子和钠离子构成的。 | |||
我评论: | |||
证明的是:氯化钠,没有特殊的能量作用,氯化钠是不可能形成氯离子和钠离的。 | |||
因此,说氯化钠,说盐水里有是独立存在的氯离子和钠离的。都是无知的。 | |||
哪一位专家教授真正白了传统理论?<ref>锑度贴吧:[https://tieba.baidu.com/p/7438287972 说氯化钠,说盐水里有是独立存在的氯离子和钠离的。都是无知的-雷氏力学吧]</ref> | |||
=== 七、晶体的结构组合 === | |||
1,任何晶体都是由物质电子的SN极的等价组合成的。 | |||
2,单质晶体是由单质物质电子的SN极的等价组合成的。 | |||
3,化合物晶体是由不同的物质电子的SN极的等价组合成的。 | |||
4,在自然条件下形的成单质的晶体中,前后左右都是不同的SN的连接组合,没有相同的S极或者N极连接在一起的组合。 | |||
5,在自然条件下形成的化合物晶体中,没有两个相同的S极或者N极连接在一起的组合。也没有两个相同的物质电子之间的连接组合。 | |||
因此,每一种晶体都有自己的特殊形状,特殊性质。 | |||
5,每一种晶体都有自己的粘接力。物质不同,温度不同,湿度不同,粘接力不同。<ref>锑度贴吧:[https://tieba.baidu.com/p/7591687450 晶体的结构组合-最爱春雷吧]</ref> | |||
希望大家慢慢理解。 | |||
=== 八、氦分子式为He的错误 === | |||
1,氦是惰性元素之一,说分子式为He是错误的。 | |||
2,He只是氦的元素符号,最多只能表示是氦元素,或者一个氦原子(管科理论)。因此,说氦分子式为He是错误的。 | |||
3,根据雷氏电磁粒子理论,He是一个氦的电磁粒子符号,有SN极。只有两个He氦的电磁粒子SN极和NS极的等价组合,才能组成一个氦的分子He2。 | |||
4,氦分子He2和任何物质分子一样,温度不同,压力不同,分子的性质不同。<ref>锑度贴吧:[https://tieba.baidu.com/p/7879475688 氦分子式为He的错误-最爱春雷吧]</ref> | |||
=== 九、元素,原子,化合价,分子与雷氏电磁粒子的关系 === | |||
1, 传统理论的元素种类=雷氏电磁粒子种类。有多少种类元素,就有多少种类的电磁粒子。 | |||
2, 传统理论说原子是化学反应不可分割的粒子是正确的。电磁粒子也是化学反应不可分割的粒子。原子和电磁粒子都是粒子状态。但是,原子结构理论是错误的。 | |||
3, 传统理论原子的化合价=电磁粒子的SN极的对数。 | |||
但是,谁也说不清楚原子的化合价是怎样产生的。而电磁粒子的SN极的对数是自然具备的。 | |||
4, 传统理论的分子是凭原子的化合价组合的。前面说了,化合价还是不明不白的东西。而电磁粒子的SN极的对数是电磁粒子自然具备的。 | |||
因为电磁粒子都有电磁力SN极,不可能独立存在。因此,雷氏分子理论是电磁粒子SN极的等价组合。 | |||
任何一个电磁粒子的SN极和另外一个同类电磁粒子的NS极组合成稳定的单质分子。 | |||
任何一个电磁粒子的SN极和另外一个不同类电磁粒子的NS极组合成稳定的化合物分子。 | |||
5, 温度不同,电磁粒子SN极的电磁力不同,组合成的分子的性质特征有所不同。 | |||
6, 宇宙中的一切物体,天体,无论大小,都是由电磁粒子组合成的。 | |||
7,希望有智商的人慢慢理解!<ref>锑度贴吧:[https://tieba.baidu.com/p/7880687792 元素,原子,化合价,分子与雷氏电磁粒子的关系-最爱春雷吧]</ref> | |||
=== 九、什么是化学反应? === | |||
化学反应:是分子的电磁粒子SN极解体后重新组合产生新分子的反应。 | |||
1, 在化学反应式中,一个电磁粒子符号只代表一个电磁粒子,不能代表分子。 | |||
比如:Fe代表1个铁的电磁粒子,4Fe代表4个铁的电磁粒子,……… | |||
2, 在化学反应式中,H2,O2,H2O才代表分子。分别代表1个氢分子,1个氧分子,1个水分子,……….. | |||
3, 独立的,单个的电磁粒子在自然界中是不存在的。只有电磁粒子之间的SN极等价组合,才能组合成稳定的分子或者晶体。人们见到的都是分子团或晶体团的物体。 | |||
4,只有在化学反应式中才可以看到独立的,单个的电磁粒子和分子式结构。那是为了方便反应式的观察和计算的方便。 | |||
比如:三氧化二铁4Fe+3O2=2Fe2O3中,Fe是电磁粒子。O2是氧分子,是两个O电磁粒子组合的。 | |||
证明:每个Fe电磁粒子有3对SN极。每个O电磁粒子有2对NS极。4个Fe电磁粒子共12对SN极和3个氧分子解体后的6个氧电磁粒子共12对NS极等价组合,才能产生2个三氧化二铁分子。 | |||
5, 三氧化二铁分子的电磁力SN极组合示意图: | |||
[[File:雷氏三氧化二铁结构.jpg|450x450像素]] | |||
{{Clear}} | |||
6, 差一个SN极都不能组合成完整的三氧化二铁分子,性质都有所不同。 | |||
7, 这就是对电磁粒子的科学证明,实验证明。希望有智商的人看明白,慢慢理解明白!<ref>锑度贴吧:[https://tieba.baidu.com/p/7883308804 什么是化学反应?-超理吧]</ref> | |||
=== 十、常见的电磁粒子NS极对数口诀: === | |||
电磁粒子物质不同,电磁力NS极的对数不同。 | |||
一,常见的电磁粒子NS极的对数口诀: | |||
1对NS极钾,钠,银,<br/> | |||
铵根,亚铜 + 氯,氢;<br/> | |||
2对NS极氧,铜,汞,<br/> | |||
还有镁,钙,钡,铅,锌;<br/> | |||
3对NS极铝,铁,铬;<br/> | |||
4对NS极硅,碳,5对磷。 | |||
二,有的同一个电磁粒子的NS极在不同的条件下有不同的对数: | |||
1,铁有FeO是2对,Fe2O3是3对的。 | |||
2,碳有CO是2对,CO2是4对的。 | |||
3,硫有SO是2对,SO2是4对,SO3是6对的。 | |||
4,氮N有多种不同的对,下面列举一些常见含氮的对: | |||
N2O(一氧化二氮)是1对;<br/> | |||
NO(一氧化氮)是2对;<br/> | |||
N2O3(三氧化二氮)是3对;<br/> | |||
NO2(二氧化氮)是4对;<br/> | |||
NaNO3(硝酸钠)2NH3(氨气)是5对。<br/> | |||
三,常见的电磁粒子对数的规律是: | |||
1,氧O的电磁粒子是固定的2对SN极。 | |||
2,从与O的SN极等价组合的分子结构中,可以准确判断其他电磁粒子的SN极对数。 | |||
比如:H2O中,H只有1对SN极。CuO中,Cu有2对SN极。Fe2O3中,Fe有3对SN极。<br/> | |||
CO2中,C有4对SN极。P2O5中,P有5对SN极。…………… | |||
四,证明;原子相关的传统理论和0化合价是错误的。 | |||
五,希望有智商,有知识的人慢慢看,慢慢理解,慢慢明白!<ref>锑度贴吧:[https://tieba.baidu.com/p/7886197135 常见的电磁粒子NS极对数口诀:-sci期刊吧]</ref> | |||
=== 十一、证明硫S不存在化合价2,也不存在2对电磁粒子 === | |||
1,一氧化硫SO:无色气体,有类似于H2S的臭味,非常不稳定。只存在于毫秒之间。 | |||
2,证明硫S不存在化合价2,也不存在2对电磁粒子。 | |||
3,证明硫S有4对电磁粒子SN极,二氧化硫SO2才是稳定的分子结构。<ref>锑度贴吧:[https://tieba.baidu.com/p/9091484902 常见的电磁粒子NS极对数口诀:-最爱春雷吧]</ref> | |||
=== 十二、不稳定分子的稳定组合 === | |||
1,雷绍武强调:任何电磁粒子、分子的SN极都不可能长时间独立存在,必须等价组合才能稳定存在。 | |||
2,举一氧化碳CO组合来说明这个问题。 | |||
3,一氧化碳CO分子中,C有4对SN极,O有2对SN极。组合后,C还有2对SN极等待组合。 | |||
4,如果有氧存在,CO会很快与O组合,生成稳定的二氧化碳CO2。 | |||
5,如果无氧存在,2个CO会很快组合,生成稳定的一氧化碳CO分子团。这是否存在? | |||
6,如果无氧存在,,4个CO会很快组合,生成稳定的2个二氧化碳CO2分子和1个稳定的碳C2分子物质。这是存在的。<ref>锑度贴吧:[https://tieba.baidu.com/p/9105788458 不稳定分子的稳定组合(原创)-最爱春雷吧]</ref> | |||
=== 十三、原子理论的错误(一) === | |||
1, 原子理论认为:一个原子由一个原子核和一个或多个围绕原子核旋转的电子组成。 | |||
2, 哪一位专家真正明白了?可否解答:电子凭什么能够围绕原子核旋转?<ref>锑度贴吧:[https://tieba.baidu.com/p/9103120650 原子理论的错误(一)-最爱春雷吧]</ref> | |||
== 参考资料及注释 == | == 参考资料及注释 == | ||
| 第60行: | 第257行: | ||
{{Template:雷论库}} | {{Template:雷论库}} | ||
[[Category:语录]] | |||
[[Category:雷氏力学]] | |||
[[Category:超理理论]] | |||
[[Category:超理化学]] | |||
[[Category:超理著作]] | |||
於 2024年7月27日 (六) 11:10 的最新修訂
此條目收錄雷紹武先生就化學方面發表的見解。
概述[編輯]
雷氏化學歷史[編輯]
相對於其他雷氏學科,雷氏化學是一門發展較晚的學科,雷紹武胡編亂造出來創新電子理論後發現電子既然不可再分,就不能用官科理論來套物質結構,於是提出了物質電子等價組合的理論,並作了甲醇、乙醇、苯的雷氏電子NS極組合結構圖[1]但是在早期,相關理論不多,梗也不多。2021年5月,有人在QQ上冒充「中科大張祖德」去加雷紹武好友討論其化學問題,這個「張祖德」對雷紹武主要是捧,多次表示雷紹武的理論「有道理」,雷紹武很喜歡他,他們的交流討論到了元素周期表上的規律(包括同族元素性質相似、對角線規則)、電解水、水與鈉反應、電解質的解離和核裂變與核聚變(編輯時間即2021年7月17日正在討論的內容是核裂變)。下文「雷紹武理論原文」中收錄的2-5就是他們交流時談到的東西(雷紹武一拍腦瓜發明出來新理論就順手發到貼吧上去了)。同年6月下旬,這個人又註冊了「吉大化院老宋」的QQ號在群里與雷紹武公開論戰數日,後來又私下論戰幾天(截至2021年7月17日仍在繼續論戰),討論內容涉及等離子體、電解質的解離、電解池、化學電源、化學鍵、熱量、物質的導電性、雷氏環丙烷與苯的結構、等效氫。下文收錄的第6部分(氯化鈉在水中)就是論戰產生的。可以說這段時間是雷氏化學蓬勃發展的時間。
理論概述[編輯]
根據創新電子理論,物質都是電磁粒子(簡稱電子)構成的,其中構成物質的那些電子叫做物質電子。物質電子其實就是雷氏理論中原子的替代品。物質電子具有NS極,並且每個物質電子都具有等量的NS極。物質電子的NS極等價組合,形成了分子。比如:兩個氫電子各自有一對NS極,氫電子A的N極與B的S極組合,A的S極與B的N極組合,就構成了一個氫分子。兩個物質電子各一對NS極形成一根共價鍵。簡單地說,雷紹武其實就是把官科物質結構里的所有鍵全部變成了共價鍵,並認為萬物,包括離子化合物的固體或溶質如NaOH、NaCl,都是共價鍵連接的分子構成的;共價鍵里的一個電子就等於一對NS極。
雷紹武理論原文[2][編輯]
一、分子不是原子組合成的[編輯]
分子不是原子組合成的
必須明白:
- 分子不是原子組合成的。
- 分子是電子的SN極等價組合成的。
- 分子電子SN極的完全組合是穩定的物質。
- 這種物質不可能產生分子的無規則運動。
- 如果分子電子SN極的等價組合後,還剩餘SN極,這是不穩定分子結構,會繼續和其他不穩定分子的NS極,或者其他電子的NS極組合成穩定物質。[3]
二、什麼叫同族元素[編輯]
什麼叫同族元素
- 傳統理論認為的同族元素,就是同族的物質電子。元素=物質電子。
- 因為同族物質電子的SN極電磁力差別不大,因此,他們的物理、化學性質大多相似。
- 其內在原理是同族物質電子的SN極電磁力強弱存在差別。[4]
三、鈉與水的反應現象[編輯]
鈉與水的反應現象:
- 2Na+2H2O=2NaOH+H2。
- 鈉與水的反應現象是鈉漂浮在水的表面,生成了無色無味的氣體H2.
- 鈉表面熔成小球狀,並且鈉在水表面來回游動,同時發出嘶嘶的聲音,。
- 這是鈉與水的反應產生鈉熔溫度,鈉分子(晶體),水分子的電磁力SN極解體產生的運動力的作用現象。
- 這是電磁力解體的聲音。是鈉分子(晶體)迅速解體生成鈉電子NS極,水分子解體生成H電子SN極和OH根SN後,與OH根的SN極組合成NaOH分子。兩個H的SN組合成H2分子。
- NaOH是鹼性分子,加入酚酞後溶液變為紅色。[5]
四、氧電子,氧分子,臭氧分子SN極示意圖[編輯]
氧電子,氧分子,臭氧分子SN極示意圖
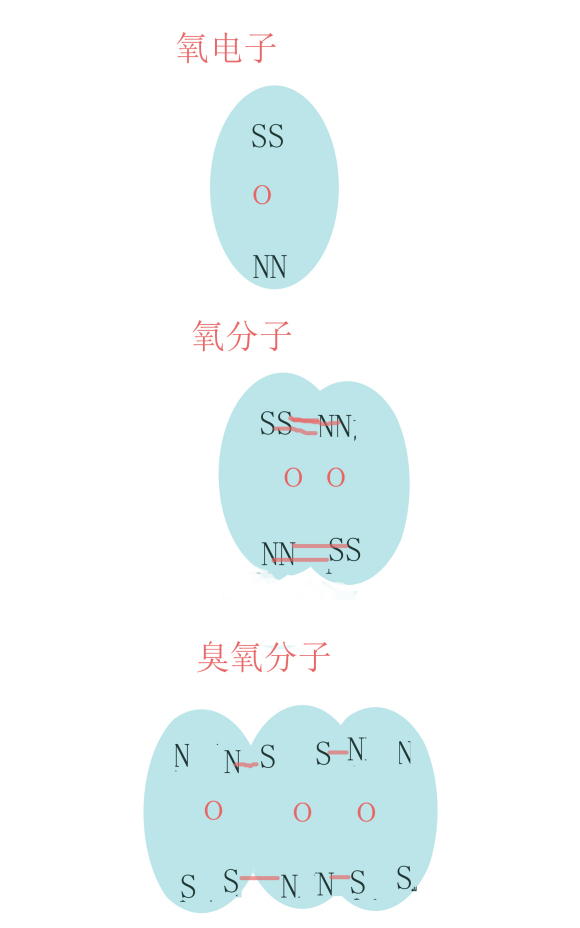
三個氧電子可以這樣組合:
中間一個氧電子,兩邊各一個氧電子,組合後,兩邊各剩下一對SN極等待組合。
因此,三個氧電子組合的分子是不穩定分子。
如果3個電子SN極串聯,可以組合從穩定分子。不是不穩定的臭氧分子。[6]
五、水電解[編輯]
水電解
- 水電解,把水弄得一點不剩,生成的全是氫氣和氧氣,證明水分子是氫電子和氧電子組合成的。
- 水電解,把水弄得一點不剩,就是電能熱能使水分子的氫電子和氧電子的SN極組合解體,生成的全是兩個氫電子SN極組合的氫氣和兩個氧電子SN極組合氧氣。
- 證明水分子是氫電子氧電子組合的。[7]
六、說氯化鈉,說鹽水裡有是獨立存在的氯離子和鈉離的。都是無知的[編輯]
說氯化鈉,說鹽水裡有是獨立存在的氯離子和鈉離的。都是無知的
無知無賴的人太多太多了。
我不願意向這些無知無賴傳播真理。
可憐這些所謂的專家教授連傳統的錯誤的離子理論都沒有弄明白。就恬不知恥,大言不慚的反對我,攻擊我:
錯誤的傳統理論認為:,1,離子是指原子或原子基團失去或得到一個或幾個電子而形成的帶電荷的粒子。這一過程稱為電離。電離過程所需或放出的能量稱為電離能。
我評論:
證明的是:這一過程稱為電離。電離過程需要能量(或者電解,或者加熱)。
2,在化學反應中,金屬元素原子失去最外層電子,非金屬原子得到電子,從而使參加反應的原子或原子團帶上電荷。帶電荷的原子叫做離子,帶正電荷的原子叫做陽離子,帶負電荷的原子叫做陰離子。陰、陽離子由於靜電作用而形成不帶電性的化合物。
我評論:
證明的是:離子是不可以單獨存在的。相同離子會相互排斥,不相同離子會相互吸引,形成不帶電性的化合物。
3,與分子、原子一樣,離子也是構成物質的基本粒子。如氯化鈉就是由氯離子和鈉離子構成的。
我評論:
證明的是:氯化鈉,沒有特殊的能量作用,氯化鈉是不可能形成氯離子和鈉離的。
因此,說氯化鈉,說鹽水裡有是獨立存在的氯離子和鈉離的。都是無知的。
哪一位專家教授真正白了傳統理論?[8]
七、晶體的結構組合[編輯]
1,任何晶體都是由物質電子的SN極的等價組合成的。
2,單質晶體是由單質物質電子的SN極的等價組合成的。
3,化合物晶體是由不同的物質電子的SN極的等價組合成的。
4,在自然條件下形的成單質的晶體中,前後左右都是不同的SN的連接組合,沒有相同的S極或者N極連接在一起的組合。
5,在自然條件下形成的化合物晶體中,沒有兩個相同的S極或者N極連接在一起的組合。也沒有兩個相同的物質電子之間的連接組合。
因此,每一種晶體都有自己的特殊形狀,特殊性質。
5,每一種晶體都有自己的粘接力。物質不同,溫度不同,濕度不同,粘接力不同。[9]
希望大家慢慢理解。
八、氦分子式為He的錯誤[編輯]
1,氦是惰性元素之一,說分子式為He是錯誤的。
2,He只是氦的元素符號,最多只能表示是氦元素,或者一個氦原子(管科理論)。因此,說氦分子式為He是錯誤的。
3,根據雷氏電磁粒子理論,He是一個氦的電磁粒子符號,有SN極。只有兩個He氦的電磁粒子SN極和NS極的等價組合,才能組成一個氦的分子He2。
4,氦分子He2和任何物質分子一樣,溫度不同,壓力不同,分子的性質不同。[10]
九、元素,原子,化合價,分子與雷氏電磁粒子的關係[編輯]
1, 傳統理論的元素種類=雷氏電磁粒子種類。有多少種類元素,就有多少種類的電磁粒子。
2, 傳統理論說原子是化學反應不可分割的粒子是正確的。電磁粒子也是化學反應不可分割的粒子。原子和電磁粒子都是粒子狀態。但是,原子結構理論是錯誤的。
3, 傳統理論原子的化合價=電磁粒子的SN極的對數。
但是,誰也說不清楚原子的化合價是怎樣產生的。而電磁粒子的SN極的對數是自然具備的。
4, 傳統理論的分子是憑原子的化合價組合的。前面說了,化合價還是不明不白的東西。而電磁粒子的SN極的對數是電磁粒子自然具備的。
因為電磁粒子都有電磁力SN極,不可能獨立存在。因此,雷氏分子理論是電磁粒子SN極的等價組合。
任何一個電磁粒子的SN極和另外一個同類電磁粒子的NS極組合成穩定的單質分子。
任何一個電磁粒子的SN極和另外一個不同類電磁粒子的NS極組合成穩定的化合物分子。
5, 溫度不同,電磁粒子SN極的電磁力不同,組合成的分子的性質特徵有所不同。
6, 宇宙中的一切物體,天體,無論大小,都是由電磁粒子組合成的。
7,希望有智商的人慢慢理解![11]
九、什麼是化學反應?[編輯]
化學反應:是分子的電磁粒子SN極解體後重新組合產生新分子的反應。
1, 在化學反應式中,一個電磁粒子符號只代表一個電磁粒子,不能代表分子。
比如:Fe代表1個鐵的電磁粒子,4Fe代表4個鐵的電磁粒子,………
2, 在化學反應式中,H2,O2,H2O才代表分子。分別代表1個氫分子,1個氧分子,1個水分子,………..
3, 獨立的,單個的電磁粒子在自然界中是不存在的。只有電磁粒子之間的SN極等價組合,才能組合成穩定的分子或者晶體。人們見到的都是分子團或晶體團的物體。
4,只有在化學反應式中才可以看到獨立的,單個的電磁粒子和分子式結構。那是為了方便反應式的觀察和計算的方便。
比如:三氧化二鐵4Fe+3O2=2Fe2O3中,Fe是電磁粒子。O2是氧分子,是兩個O電磁粒子組合的。
證明:每個Fe電磁粒子有3對SN極。每個O電磁粒子有2對NS極。4個Fe電磁粒子共12對SN極和3個氧分子解體後的6個氧電磁粒子共12對NS極等價組合,才能產生2個三氧化二鐵分子。
6, 差一個SN極都不能組合成完整的三氧化二鐵分子,性質都有所不同。
7, 這就是對電磁粒子的科學證明,實驗證明。希望有智商的人看明白,慢慢理解明白![12]
十、常見的電磁粒子NS極對數口訣:[編輯]
電磁粒子物質不同,電磁力NS極的對數不同。
一,常見的電磁粒子NS極的對數口訣:
1對NS極鉀,鈉,銀,
銨根,亞銅 + 氯,氫;
2對NS極氧,銅,汞,
還有鎂,鈣,鋇,鉛,鋅;
3對NS極鋁,鐵,鉻;
4對NS極硅,碳,5對磷。
二,有的同一個電磁粒子的NS極在不同的條件下有不同的對數:
1,鐵有FeO是2對,Fe2O3是3對的。
2,碳有CO是2對,CO2是4對的。
3,硫有SO是2對,SO2是4對,SO3是6對的。
4,氮N有多種不同的對,下面列舉一些常見含氮的對:
N2O(一氧化二氮)是1對;
NO(一氧化氮)是2對;
N2O3(三氧化二氮)是3對;
NO2(二氧化氮)是4對;
NaNO3(硝酸鈉)2NH3(氨氣)是5對。
三,常見的電磁粒子對數的規律是:
1,氧O的電磁粒子是固定的2對SN極。
2,從與O的SN極等價組合的分子結構中,可以準確判斷其他電磁粒子的SN極對數。
比如:H2O中,H只有1對SN極。CuO中,Cu有2對SN極。Fe2O3中,Fe有3對SN極。
CO2中,C有4對SN極。P2O5中,P有5對SN極。……………
四,證明;原子相關的傳統理論和0化合價是錯誤的。
五,希望有智商,有知識的人慢慢看,慢慢理解,慢慢明白![13]
十一、證明硫S不存在化合價2,也不存在2對電磁粒子[編輯]
1,一氧化硫SO:無色氣體,有類似於H2S的臭味,非常不穩定。只存在於毫秒之間。
2,證明硫S不存在化合價2,也不存在2對電磁粒子。
3,證明硫S有4對電磁粒子SN極,二氧化硫SO2才是穩定的分子結構。[14]
十二、不穩定分子的穩定組合[編輯]
1,雷紹武強調:任何電磁粒子、分子的SN極都不可能長時間獨立存在,必須等價組合才能穩定存在。
2,舉一氧化碳CO組合來說明這個問題。
3,一氧化碳CO分子中,C有4對SN極,O有2對SN極。組合後,C還有2對SN極等待組合。
4,如果有氧存在,CO會很快與O組合,生成穩定的二氧化碳CO2。
5,如果無氧存在,2個CO會很快組合,生成穩定的一氧化碳CO分子團。這是否存在?
6,如果無氧存在,,4個CO會很快組合,生成穩定的2個二氧化碳CO2分子和1個穩定的碳C2分子物質。這是存在的。[15]
十三、原子理論的錯誤(一)[編輯]
1, 原子理論認為:一個原子由一個原子核和一個或多個圍繞原子核旋轉的電子組成。
2, 哪一位專家真正明白了?可否解答:電子憑什麼能夠圍繞原子核旋轉?[16]
參考資料及注釋[編輯]
- ↑ 需要注意的是,雷紹武在圖里常常省略一半NS極,一個電子有等量的NS極,他一般某個電子只畫N極,與它相組合的電子只畫S極,只畫S極相鄰的電子只畫N極。剩餘的一半的極只需要把圖中已畫出的所有N極旁標上S極,在S極旁標上N極就能表示出來。
- ↑ 本文中一些化學式的書寫方法和標點符號的使用方法可能與規範用法不同,這是因為原文如此,並不是編輯者的失誤。
- ↑ 銻度貼吧:分子不是原子組合成的-民科吧
- ↑ 銻度貼吧:什麼叫同族元素-民科吧
- ↑ 銻度貼吧:鈉與水的反應現象:-民科吧
- ↑ 銻度貼吧:氧電子,氧分子,臭氧分子SN極示意圖-民科吧
- ↑ 銻度貼吧:水電解-民科吧
- ↑ 銻度貼吧:說氯化鈉,說鹽水裡有是獨立存在的氯離子和鈉離的。都是無知的-雷氏力學吧
- ↑ 銻度貼吧:晶體的結構組合-最愛春雷吧
- ↑ 銻度貼吧:氦分子式為He的錯誤-最愛春雷吧
- ↑ 銻度貼吧:元素,原子,化合價,分子與雷氏電磁粒子的關係-最愛春雷吧
- ↑ 銻度貼吧:什麼是化學反應?-超理吧
- ↑ 銻度貼吧:常見的電磁粒子NS極對數口訣:-sci期刊吧
- ↑ 銻度貼吧:常見的電磁粒子NS極對數口訣:-最愛春雷吧
- ↑ 銻度貼吧:不穩定分子的穩定組合(原創)-最愛春雷吧
- ↑ 銻度貼吧:原子理論的錯誤(一)-最愛春雷吧
| 雷先生的書庫 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 您正在閱讀:《雷氏化學創新理論》。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
