超理文献:鿬元素超理学:修订间差异
PandaFiredoge(留言 | 贡献) 小 PandaFiredoge移动页面超理文献:鿬元素超理学至超理文献1:鿬元素超理学,不留重定向:批量移动:为创建“超理文献”命名空间做准备 (步骤 1) |
PandaFiredoge(留言 | 贡献) 小 PandaFiredoge移动页面超理文献1:鿬元素超理学至超理文献:鿬元素超理学,不留重定向:批量移动:移动到“超理文献”命名空间 (步骤 2) |
||
(没有差异)
| |||
2025年4月27日 (日) 11:35的最新版本
《鿬元素超理学》是伊夫·奥克基编写的一部锑际大学教材,目前已修正至第二版。
原书[编辑]
导语[编辑]
之前有机Ts的弃掉了,准备并入这里来
注意:本帖有一部分根据真理推断的内容,但也含有有超理
对于不知道超理的路人,事先声明,本帖基本上都是虚构,请勿相信。
普通超重元素化学(普通超重元素超理学)是研究超重元素(除部分特殊超重元素,如钱)的一门超理学科,最早人们对于这些元素并不重视,而是热衷于无限的文字守恒和有机画学当中,但随着超重元素的用途被人们发觉,这项学科也开始蓬勃发展,自1973年超重元素化学和锑宙科技开始高速发展以来,人们对于超重元素的重视程度也开始日益增长,如鎶凭借自身沸点低的特性在许多方面都出现了重要的应用,而Ts也伴随这些元素开始出现在普通人的视野。事到如今,Ts已经在文字守恒,制药,超理物理学研究以及其他方面拥有巨大的用途。
Ts是锑宙中丰度最低的卤族元素之一,它的丰度仅有不到0.00000002%,因此大部分是使用文字守恒来制备的,虽然丰度很低,但是它在现代超理工业上却拥有着巨大的潜力,如一种含Ts,Tl,O,At,Sn,Mo的一种成分复杂并且以杂多酸盐为主要成分的材料在半无线电力的研究方面以及被研究很多,并且有种种证据表明它在未来会是一种普遍的合成新一代陶瓷导体的重要材料,NaTs的稀释溶液是放射治疗药物中的一个新的重点研究对象。
Ts也可以取代碳上的氢原子,形成与其他卤代化合物截然不同的Ts代有机物,这类有机物表现出了许多特殊的性质,例如在MeAlO2与AsI3的催化下CH3Ts与Hg(CH3)2反应可以形成在结构上类似于三甲基䐂而性质上却不同于三甲基䐂的三甲基鿬,这些Ts-C化学键构成了许多重要的有机材料。
Ts在超理学研究上因为表现一部分出不同于一般卤素的性质,故它也可以被拿来推测一部分尚未被合成的更重的元素,例如依靠Ts与At的性质差异推测出来的eka-Mc的实际性质就与推测结果基本一致。
这些迹象都表明了Ts化学越来越重要,Ts化学作为一个刚刚兴起的超理学科,正在不断发展着。
第一章 Ts元素历史[编辑]
1.1 发现[编辑]
公元前3000年,年轻的赵明毅大师利用铀锑云母成功制备了锑星历史上第一块砹单质,震惊了当时的化学界,同时赵大师用这些立方砹做了些试验,验证了砹的许多性质,并指出其与一般卤素的不同性,如:次砹酸是一种两性电解质,砹离子在水中可以以At+的形式稳定存在,看到砹的许多不同于常规卤素的性质,赵大师十分兴奋,并马不停蹄的推测砹下方的元素——eka-砹的性质,他与好朋友锇星超理学家钔捷列夫一起通过理论计算推测了该物质的性质,他们一致认为eka-砹将继承砹的性质,并体现出更强的金属性,但是,他们忽略了许多对eka-砹性质影响的关键因素,比如说原子内部的一些重要的作用力。
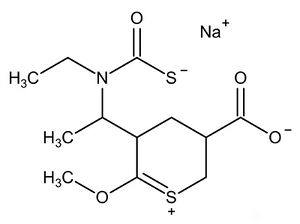
公元前2800年,赵明毅对一堆富含砹元素的废液发功后将自己利用分子画板随便乱画的一种有机物加入到废液当中,结果发现废液呈鲜红色,这令赵大师感到好奇。经过查证,这种有机物是{[1-(5-羧基-2-甲氧基-3,4,5,6-四氢-1λ^4-硫吡喃-1-亚乙基-3-基)乙基](乙基)氨甲酰}磺胺λ^1-靛蓝酰亚胺钠盐(后世称作Ts试剂,简写为NaTsn),该化合物在常规条件下显无色,在At+和AtO+溶液中也是无色,但是在该废液中却能显鲜红色,赵大师起先认为这是某种已知的过渡元素,但是他经过种种实验分析,判断废液中存在有一种新元素,并且不属于过渡系,并请锂大锑利用分析技术分析该溶液成分,锂大师发现,该溶液中含有一种新元素,也就是之前大家一直推测的eka-砹,原来,这种有机物上的硫吡喃正离子与一硫代羧基上的硫负离子可以与水溶液中的Ts+离子发生配位,形成鲜红色的配合物[Ts(HTsn)]3Tsn3,这种配合物能被乙酸异丙酯给萃取,形成紫色溶液,赵大师于公元前1799年在《时代锑星》上发表了一篇名为《一种全新的卤族元素》的论文,开始了今后Ts元素超理学研究的大门。
公元前2782年,赵大师又在原料稀缺的情况下合成了几种Ts化合物,分别是TsF、KTsF4、HTsO以及HTsO2,同时通过电解难溶于水的KTsF4制备到了3g金属态Ts单质,赵明毅再次于锑际《时代锑星》杂质上发表了自己的研究成果,一度引来化学界热议,许多超理学家都争着向赵大师索要Ts单质,但是都遭到拒绝,之后的几十年里,Ts都只是超理学上的花瓶,无实际意义。
1.2 曲折的发展[编辑]
公元前2692年,氯星青年科学家vaspier在对极度稀有的砹汞矿(主要成分为砹化亚汞及其碱式盐)进行酸化处理时候,发现了难溶性残渣经过过硝酸(HNO4)处理后产生了一些难溶性白色沉淀,vaspier使用红外光谱仪检验其成分,发现了其中含有之前一直只有高级实验室才能拥有的Ts元素,于是,他立即对其发功,成功获得1.1g Ts单质,成功打破了“Ts在自然界中不存在”的假说。但是由于当时文字守恒盛行,所以并没有受到重视。
出于文字守恒热,Ts元素的研究一直沉寂到了1450年。
1456年,
第二章 单质[编辑]
2.1 概述[编辑]
因为种种物理学原因,Ts和At在性质上开始有点有悖元素周期律,与前四种卤素的性质开始表现出许多差异,开辟出一条新路来重新抽枝,这一点差异主要来源于超重元素的极强的自旋-轨道作用和锑铌场电子纠缠作用,使得它们价电子层上的其中两个电子在化学反应中逐渐体现惰性,同时从氟到鿬,原子半径逐渐增大,根据电负性计算的方程式,Ts和At的电负性也越来越小,At即便有锑场的支持,电负性也只能高出氢半个头,Ts就更无需可言。
2.2 种类[编辑]
2.2.1 金属Ts[编辑]
Ts的最稳定单质是金属质地的金属Ts,它的化学式一般写作Ts,其中Ts原子呈六方最密堆积,与At在锑星上的的简单立方堆积有相似之处,常温下,这种结构的Ts单质具有银灰色的表面,同时还泛有微微的浅蓝色金属光泽,它在330°C发生熔化,550°C时原有的结构被改变,形成极深的蓝黑色的气态Ts2分子,并在较冷处转化为为不够稳定二鿬固体或液体,因为Ts的沸点和熔点相去甚远,故无法观察到类似于I2因熔沸点相近而产生的的“假升华”现象。
标况下,金属Ts硬而脆,莫氏硬度为7,但是延展性很差,极易被折断,利用电解或发功亦或气相沉积法制备出来的Ts晶体一般呈现类似于钇的细丝状,电阻率在460以上,并不是一种优秀的导体,但是当温度降低至-51°C时,它的导电性会逐步提升,直到-199°C时,它的导电性已经接近于常温下的铜,-233°C时转化为超导体,这种物质在半导体材料学上有很大的潜力,并常常被参杂到黄铜当中以增强抗腐蚀性。
金属Ts在一般条件下比较稳定,常温下几乎不与绝大多数氧化性一般的氧化剂反应,需要加热到230°C时才会和氧气反应形成三氧化二鿬,60°C时与浓硫酸反应形成硫酸氧亚鿬((TsO)2SO4),二氧化硫和水,120°C时则和氯气反应形成三氯化鿬,但遇到高活性的强氧化剂或极强的氧化剂时就会发生剧烈反应,能与ICl,F2,HO2等物质剧烈反应,甚至引发爆炸。
2.2.2 单原子气体Ts[编辑]
单原子气体Ts是一种十分不稳定的Ts单质,又称Ts原子自由基,它只能在高温下存在,化学式一般写作Ts。金属Ts虽然会在加热到沸点时形成双原子Ts,但是双原子Ts在加热至750°C以上时会可逆地裂解为单原子气体Ts,该反应在800°C时平衡常数为1000,在1200°C时,双原子Ts将完全转化为单原子气体Ts,而在冷却至820°C以下时将有73%左右的单原子Ts重新变为Ts₂,780°C时全部转化为Ts₂。目前气体单原子Ts还未发现任何民用用途,但是在一些实验室,人们可以利用高速运动的螺旋锑子轰击气态单原子Ts,得到铕的同位素和含有锑子的氙同位素。
锑子的质量大约是0.2U,类似于氢-4.1包含了2个质子和2个中子,与氦-4类似,但其中一个电子被μ子取代,而这种粒子的质量大约是0.1U,故可以将该原子视作氢4.1,锑子是一种性质很特别的微观粒子,人门利用微观放大镜得知它会顺着轨道来到原子核内部,并与原子核融为一体,但是这个过程并不是很稳定,想要制得含锑子的同位素,让锑子高速轰击原子,把锑子塞入原子核才是保守之策,而锑子体积很小,使用Ts这类超重元素的较重同位素可以提高制备含锑子同位素的成功率。
气态单原子Ts的反应性将是所有Ts单质中最高的一种,原因是Ts原子外围还含有一个未成对电子,使得其反应性加强
气态单原子Ts和I₂于800°C反应时,该反应方程式如下:
2Ts·(g)+I2(g)→2TsI(g)
TsI(g)+I2(g)⇌TsI₃(lq)
气态单原子Ts在超强铌场的激发下将失去部分电子,并形成自由电子,从而变成高导电性气体,与一般导电性气体不同,Ts·可以随铌场波的方向表现出单向导电性,其导电方向与铌场波的方向基本一致,但如果单纯使用超强锑场的话,Ts·从表面上看无任何明显迹象,但是当有铌场源靠近时,装有Ts·气体的容器内将会发出尖锐的爆鸣声,同时可以观察到放电迹象,这个反应所需的铌场仅需0.01标准铌场就可以达到,据赵明毅大师在《初级锑场学》所描述的内容而言,这种情况可能是因为Ts·被超强锑场激发引发7p轨道上的一个电子进行能级跃迁,同时超强铌场和超强锑场具有极强的互斥力,这种斥力影响到了能级跃迁后不稳定的新Ts·原子,引发Ts·放电,另外此反应还观测到了不可见光,同时,赵大师还写道“如果对其充分发功,最后反应体系冷却时内部将不会有含Ts物质剩余。”造成这种现象的原因有许多,一是Ts·在锑场激发下变得十分活泼,能参与许多反应,发功时,Ts·发生文字守恒,形成二硫化氚,二硫化氚不稳定,会直接分解为硫和硫化氚,但是种种迹象也表明这不仅仅包含一个文字守恒,还包含Ts原子的分解等等。
2.2.3 双原子分子Ts[编辑]
双原子分子Ts,化学式为Ts₂,这个构造遵循了元素周期律,其中Ts-Ts键键能较低,在锑星地表标准状况下仅108.9kJ/mol,但因为Ts原子在加热时会释放一部分Ts场,加大了这个键的稳定性,但是Ts-Ts键键能在0.5标准Ts场的作用下与在1标准Ts场作用下差别很小。
双原子分子Ts有时也被称为卤素Ts,它是所有Ts单质中溶解性最好的一个,但依然溶解性很差,难溶于水,极微溶于乙醇,微溶于四氯化碳,乙醚,汞,苯,略溶于极水,热的超乙醇,氯仿,二氯甲烷,热的四氢呋喃,二硫化碳,沸腾的农鈇三醛,CoLa胶体溶液,所以一般以固体的形式在Ts场下稳定后分装,价格高于普通Ts。
Ts₂常温下为黑色类似于碘的晶体,属于正交晶系,不稳定,常温下可以缓慢分解,在液相内有Ts单质生成的反应中,一般的产物是Ts₂,Ts ₂会逐渐变为金属Ts,它相对于金属Ts具有更高的反应活性,类似于硒,可以在浓O₂中燃烧,在120°C左右和Na反应形成NaTs和NaTsx,而金属Ts需要280°C才反应,此外,Ts₂在惰性气体中与铜加热,可以获得CuTs,这是金属Ts很难办到的。
Ts₂在Ts场较低的情况下常温下就可以自发互变为金属Ts,但是,在1标准Ts场下,它将十分稳定。
第三章 化合物[编辑]
-I价鿬化合物[编辑]
随着原子半径的增加,主族元素开始变得很难接受电子以达到8电子稳定结构,换言之,其负价也越来越不稳定,单质的氧化电位也会降低,氟化物稳定到无论怎么捣鼓都难以分解,氯化物只能在强酸性条件下被强氧化剂不完全氧化,溴化物在空气中较为稳定,会被浓硫酸等物质氧化为溴,而碘化物已经具有很强的还原性,在空气中能自发变质,砹化物甚至表现出了还原水的倾向,盐类鿬化物在化学性质上将会表现得比前几者更加不稳定,以比较稳定的鿬化钠为例,这种物质在空气中见光放置8个小时会完全被氧化为亚鿬酸钠,这种变质速度让其保存在早期都成了个难题,市售的工业级鿬化钾往往因为制作工艺问题