「超盐酸」:修訂間差異
imported>Firedoge2023 無編輯摘要 |
PandaFiredoge(留言 | 貢獻) |
||
| (未顯示由 8 位使用者於中間所作的 26 次修訂) | |||
| 第1行: | 第1行: | ||
-{H|鉲; zh-hans:鉲; zh-hant:鉲; zh-cn:鉲; zh:鉲;}-{{这不是真相}} | |||
{{存在英文版本|Hyperhydrochloric Acid}}{{FA}} | |||
{{化合物信息 | |||
| title1= | |||
| image1=超理吧.jpg | |||
| caption1=超盐酸 | |||
| 化学式=(HCl)<sub>10</sub> | |||
| 分子量=364.61 | |||
| 学名=1,2,3-三乙亚氯烷基环丁亚氯烷 | |||
| 别名= | |||
*三乙亚氯烷基环丁亚氯烷 | |||
*超盐酸 | |||
| 颜色= | |||
| 物态=气态 | |||
| 沸点=273.15K(1标准大气压) | |||
| 熔点=理论熔点为-273.15K(实际尚未制得其晶体) | |||
| 升华点= | |||
| 凝华点= | |||
| 闪点= | |||
| 密度=2.013×10<sup>3</sup | |||
於 2025年4月19日 (六) 13:02 的最新修訂
- For the English version, please see Hyperhydrochloric Acid.
三乙亞氯烷基環丁亞氯烷,全名1,2,3-三乙亞氯烷基環丁亞氯烷,分子式為(HCl)10,俗稱超鹽酸(Hyperhydrochloric Acid),摩爾質量364.61g/mol,是一種重要的強酸。
著名超理學家趙明毅早在公元前250年前後便發現了超鹽酸,並提出了其製備方法。後來他和他的弟子又對超鹽酸的性質進行了較為深入的研究。可以說,超鹽酸的發現是超理學發展史上的一座里程碑。
歷史[編輯]
有關超鹽酸的記載大多出現在《銻氏秘集》中。相傳此書由趙明毅在銻星的安提莫尼王朝年代間寫作,此書主要記載了他的生平和他在超理學方面的成就。
| 《銻氏秘集》選段 | |
|---|---|
安氏[1]五十一年[2],銻星日禺[3]時,天有大聲如雷,乃一大銻,幾如碲[4],見於東南。少時而又震一聲,移著西南。又一震而墜在趙氏園中,遠近皆見,火光赫然照天,趙氏藩籬皆為所焚。是時火息,視地中有一竅如杯大,極深。下視之,大銻在其中,熒熒然。久之,發其竅,深三尺餘,乃得一銻石,猶熱,其大如拳,一頭微銳,色如銻,重亦如之。塗效灰得之,送槲州銻星大學,至今匣藏,兲星[5]人到則發視。後嘗使人碎之,則有氣涌而出。其色略緋,味芳香而辛[6]。俄而逸散,不知所蹤。人皆奇之。趙明毅為之傳甚詳[7]。
琉鵬[8]3.8年春,明毅尿酣[9]。聞石間泉聲,因舍棹進,策步入缺岸。初見礦[10]如疊如削,其怪者如引臂[11],如垂幢[12]。次見水,如瀉如灑,其奇者如懸練,如不絕線。水色緋,有芳香[13],因奇之。遂相與維舟岩下,率僕夫芟蕪刈翳[14],銻[15]危縋滑,休而復上者凡四五焉。仰銻[16]俯察,絕無人跡,但酸石相薄[17],磷磷鑿鑿,跳珠濺玉,驚動耳目[18]。俄而峽山昏黑,雲破碲[19]出,光氣[20]含吐,互相明滅[21],昌熒玲瓏,象生其中[22]。雖有敏口,不能名狀。注釋
| |
上述兩段記載是為數不多的有關超鹽酸的史料,其中還記載了諸多自然界的超理現象。這同時表明超理與人們的生活是息息相關的,人們的身邊,處處都有超理。只要勇於探索自然界的奧秘,你就能成為下一個趙明毅!
製備[編輯]
無論是工業生產,還是實驗室合成,超鹽酸的製備都具有重要意義,是反映國家工業、科研實驗室水準的重要指標,並且在各類罕見化合物的製備中扮演不可或缺的重要角色。
工業生產[編輯]


超鹽酸是重要的化工產品,但是由於其實驗室合成的條件已相當苛刻,基本無法工業化生產,所以現在各大化工廠都是高額向化學實驗室分批收購,通過特別的鍍銫卡車運輸。由於各實驗室的RP有所不同,送來的超鹽酸也有所不同,所以工業製品超鹽酸的濃度不高,質量也不甚好。
實驗室合成[編輯]

金屬高溫催化法[編輯]
超鹽酸的合成條件很苛刻,一種人工的實驗室合成方法,是由中國籍銻星裔的著名物理學家、化學家、超理學家趙明毅於公元前250年發現的。
《銻氏秘集》中有關記載為:「兲星(銻星的舊稱)冬月,降霜(銻星空氣中存在氯化氫,遇冷液化成霜)味辛。掃取以水淋汁,金屬倒入鍅制器,發功煎煉而成。啟之,則色雅氣芳,人皆好之。乃貢之於陛下,上用以熏殿,數日而香不散。」
秘集中還說,這個方法「得天獨厚,渾然天成,乃銻氏趙家之秘傳也」。但上述記載似乎刻意模糊了製備的詳細過程,且由於年代久遠難以考證,他是否真正合成了超鹽酸已不得而知。所以現代學者多認為趙明毅只提出了這一方法,但並未應用該方法。
銻鉲催化法[編輯]
2007年,經萬草園主的研究和改良,提出了當今世界各地使用的方法——銻鉲催化法,在實驗室合成塔進行。其步驟為:在盛有γ-鉲和銻單質的密閉容器中配製38%的氯化氫水溶液,小心把溫度升高到523.15K,壓強升高到500MPa,氯化氫分子會按10:1的比例化合成(HCl)10分子。該反應的機理如下:
- 2分子氯化氫在γ-鉲的催化下生成反-乙氯(III)烯((E)-1λ3,2λ3-dichlorene),再加成1個HCl分子生成一氯代乙氯(III)烷(1λ3,2λ3-trichlorane)。
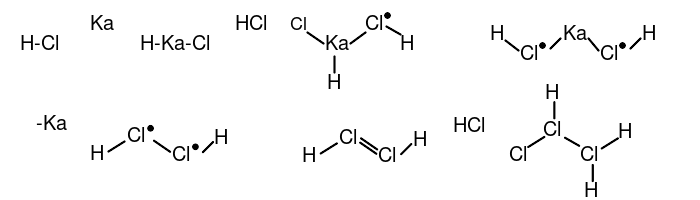
- 3分子一氯代乙氯(III)烷在銻單質的催化下形成四元氯環:三乙氯(III)烷基環丁氯(III)烷(tris(1λ3,2λ3-dichloranyl)-13,23,33,43-tetrachloretane)。(以下用R-代表乙氯(III)烷基)。

太陽能催化法[編輯]
將250mol氯化氫緩緩通入一大容積的圓底燒瓶,並將燒瓶暴露在義大利的陽光下。經過約3.153×107s,反應完成。圓底燒瓶內出現25mol的三乙亞氯烷基環丁亞氯烷。製取時務必注意,該反應不可用螺紋蓋玻璃小瓶代替圓底燒瓶,否則反應速率會大大降低,甚至無法進行。經進一步研究,用加利福尼亞的陽光替代義大利的陽光,反應時間可以縮短近一半(1.7×10^7s)。新合成的超鹽酸往往混有HCl雜質,人們通常利用二者沸點不同而將其分離純化。
該製備方法的優勢在於免去了銻和鉲的催化,但需要耗費大量時間,因此未被廣泛採用。
水銀催化法[編輯]
據趙明毅稱,他發現了直接製取高純超鹽酸的催化劑水銀(Ag·H2O)。由於該方法目前被嚴格保密,人們無法獲得更深層的資料。
煉輝銻礦法[編輯]
日前有科學家稱,輝銻礦在被加熱時會伴有超鹽酸酸霧的產生。他還提出,這是由於輝銻礦形成的微弱的銻場導致的。目前尚未證實這一說法。
結構[編輯]
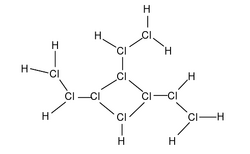

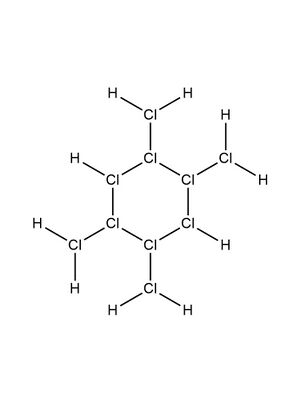
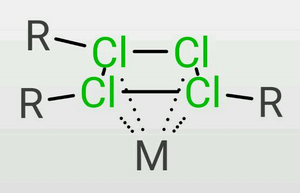
超鹽酸是一個結構複雜的化合物,按照經典的布-萬氏結構式,超鹽酸的結構如圖1(三價氯)。此外,有0.1%的超鹽酸的結構如圖2(五價氯)。兩種結構為互變異構體。
但這一模型難以解釋超鹽酸獨特的理化性質。因此,趙明毅運用量子超理學,成功解釋了超鹽酸複雜的結構。實際上,超鹽酸在剛合成時成鍵的確如圖所示。但在合成後約0.38s,氯原子核開始按照超理統計規律分裂,即每個氯原子核完全分裂成質子和中子。中子幾乎保持靜止,而180個質子則通過強相互作用形成了龐大介穩的p180結構,即趙明毅所說的「魔鍵」(圖3)。其餘的180個電子在這個結構中高速運動,由於此時原子核事實上已經不存在,電子可以看作既在原子核中運動又在原子核外運動。趙明毅對超鹽酸結構的解釋被稱為質子軌道理論。該理論很好地符合了實驗結果,因此趙明毅獲得了1098年的第一屆沈括杯夢溪化學獎。
超鹽酸還有一種異構體,即四䐂基環己亞氯烷,全名四甲亞氯烷基環己亞氯烷,俗稱異超鹽酸,結構見圖4。
物理性質[編輯]
超鹽酸[編輯]
超鹽酸的密度為2.013×103kg/cm3,氣態時密度為16.27g/L。經推算,超鹽酸的理論熔點為-273.15K(實際尚未製得其晶體),沸點273.15K(1標準大氣壓)。
超鹽酸在常溫常壓下是淡粉色氣體。理論推測,純的超鹽酸是無味的,但目前合成的超鹽酸具有芳香的氣味,這可能是因為混有部分芳香烴(由質子再結合引起)的緣故。超鹽酸能與水、乙醇、苯、水銀(Ag·H2O)、超硝酸、臭溴、脫碳甲醛、四氧化碳以任意比例混溶。
超鹽酸的水溶液[編輯]


超鹽酸的水溶液一般呈漂亮的橘紅色,由稀至濃依次為淡粉色、粉紅色、橘紅色、玫瑰紅色。
一般來說,實驗室使用0.025mol/L或0.661%的超鹽酸水溶液,pH≈0.602,密度約1.38×103kg/m3。有時會用較濃的超鹽酸,即0.25mol/L或6.037%的超鹽酸水溶液,pH≈-0.398,密度約1.51×103kg/m3。市售的濃超鹽酸一般濃度在2.50mol/L左右,即質量分數52.386%,pH≈-1.398,密度約1.74×103kg/m3。
據傳著名超理學家趙明毅所開辦的趙氏試劑店曾出售過質量分數高達380%的極濃超鹽酸,引得銻星諸多著名料學家、超理學家競相購買。塗效灰曾自豪地在他的自傳中提及此事:「Wos hige sh abi!(銻星語)」
化學性質[編輯]
超鹽酸的化學性質繁多,下面僅列出最主要的部分。若欲查看更加前沿的超鹽酸的理論研究,請移步本詞條末關於超鹽酸前沿性質研究的欄目。
酸性[編輯]
超鹽酸具有極強的酸性。高中超理學規定,超鹽酸、超硫酸、超硝酸、超魔酸、紅氧化氫、高氟酸為六大無理強酸(參見《無理化學 第五版》)。
以下是一些常見的反應:
- (HCl)10+10NaOH→Na10Cl10+H2O
- 10Yr+(HCl)10→Yr10Cl10+5H2↑(Yr為119號元素𨭦)
- 5Ag·H2O+(HCl)10→Ag5Cl10+5H4O(Ag·H2O為水銀;Ag5Cl10為超鹽酸高銀,其中銀呈+2價;H4O為水合氫氣分子)
電離[編輯]
超鹽酸是很強的質子酸,在水溶液中完全電離出180個氫離子(質子)和1個一百八十五中子合一百八十電子離子。該電離方程式如下:
- (HCl)10$ \rightleftharpoons $ 180H+ + [n185e180]180−
經理論測算,超鹽酸的酸性為魔酸的3.451×107倍,但由於條件的限制,目前在超鹽酸的水溶液中並沒有觀測到(HCl)10分子。所以超鹽酸被看作是真正的完全電離。
氧化性和還原性[編輯]
因為超鹽酸中存在幾乎裸露的質子和電子,它具有極強的氧化性和還原性,僅次於電極。其氧化還原的標準電極電勢如下:
- (HCl)10 + 180e-$ \rightleftharpoons $ 90H2 + [n185e180]180− EΘ=50.0V
- 175D+ + 5T+ + 180e-$ \rightleftharpoons $ (HCl)10 EΘ=50.0V
由於其標準電極電勢高於地球人安全電壓36.0V,超鹽酸在氧化還原中的使用受銻星標準APS-B0250[1]的嚴格控制。
超鹽酸強氧化性與強還原性的並存令Hamboltpenguin博士為之痴迷。經過1年的潛心研究,這位來自南極洲的女化學家根據量子力學的成果,提出了電子疊加理論。根據該理論,[n185e180]180-離子在溶液中變為帶負電的中子體系,即0號元素:中子形成中子能量壁壘,電子在其中高速運動,使得質子與電子分開,分別體現氧化性與還原性。
氧化性[編輯]

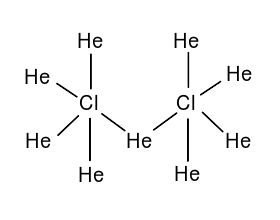
超鹽酸能氧化氦氣,產生9273.15K的高溫,生成一種彩色螢光的液體。經趙明毅測定該產物為二氯化九氦,但其中氦的分數氧化數令他百思不得其解。2007年2月,萬草園主在經過了閉門29天的「格舊書致知」,終於提出了He9Cl2的布-萬氏結構式(如圖6)。並根據「誘導效應」,判斷其中的Cl為-5價,8/9的He為+1價,1/9的He為+2價。
- (HCl)10 + 9He→He9Cl2 + H2 + 8HCl
超鹽酸能氧化氟氣,生成氫氣和黑色固體FCl。經測定,固態FCl為離子晶體F+Cl-,其晶體結構為氯化銫型。對於為什麼在FCl中氟顯正價目前眾說紛紜。比較認同的解釋是因為氟的電子親合勢小於氯,同時比氯少了3s、3px、3py和3pz四個軌道的緣故。
- (HCl)10 + 5F2→5H2 + 10FCl
還原性[編輯]
超鹽酸在電-質子隔離膜(銻化鉲)的作用下可直接還原鹼金屬化合物為單質。在約100~150K的溫度條件下,超鹽酸可以被鹼金屬(Cs除外)氧化,生成負氧化態的鹼金屬化合物,如超鹽酸鈉(Cl10Na10)等。
腐蝕性[編輯]

超鹽酸具有極強的腐蝕性,能溶解Pt、Au、V等和幾乎所有的有機物(包括聚四氟乙烯):
- (HCl)10+Au→Au(HCl)9+Cl2
- (HCl)10+3V→V(HCl)8+VH2+VCl2
但是Cs單質卻會在其中鈍化,生成難溶的配合物Cs(HCl)10。因此超鹽酸通常用純銫制的器皿盛裝。
- (HCl)10+Cs→Cs(HCl)10
其它[編輯]
日前,日本科學家最新論文表明「水裡過量的氫氘比是因為化學反應使氫緩慢地變成氘」,水中的中子被超鹽酸浸潤脫出了。這是超鹽酸與非電磁相互作用型物質反應的典範。
由於超鹽酸會在強銻場環境下與水發生以下劇烈反應,因此對於超鹽酸的水溶液的實驗必須在弱銻場環境下和無銻場環境下進行,反應會生成高氯酸和大量氫氣:
生物活性[編輯]
以下是有關超鹽酸生物化學方面性質的研究。這些研究都和人們的日常生活緊密相關,表明超理學是與生活緊密相關的,並且能夠造福人類。
胃液[編輯]
據報道目前在人類的胃液里發現了[n185e180]180−。很有可能人類在利用微量的超鹽酸消化,而不是所謂胃蛋白酶。這一發現證明了人體是一個精密協調的系統,可以合成很多自然界中難以合成的物質。同時這也說明了現代生物學理論有待進一步的修正與完善。
光合作用[編輯]
近期,巴西植物學家在南美亞馬遜叢林裡發現了一種新的綠色植物。據檢測,它的光合作用暗反應途徑既不是C3途徑也不是C4途徑,而是比C4途徑效率更高的新途徑。經過更嚴格的分析,該植物中還原CO2的第一個產物是超鹽酸烷(CCl)10,因此該途徑被命名為C10途徑。C10植物固定CO2的效率約為C4植物的1000倍。後來,智利農業學家發現C3植物的DNA中普遍存在一種編碼十碳超鹽酸酶的基因,在超鹽酸大量存在時會表達,合成十碳超鹽酸酶,以合成超鹽酸烷,使C3植物轉化為C10植物。該方法已被廣泛運用於種植業中。由於此方法的應用,現在全球糧食產量已達到3年前的800倍,各經濟作物的種植園也在世界各地如雨後春筍般湧現出來。
長生不老[編輯]
等電子的氯博士與兔子喜歡硫酸銅博士於2007年在生物化學方面有了新的突破。他們發現,細胞胞漿中H+的轉移可以以[n185e180]180−為媒介。眾所周知,生物體內很多氧化還原反應產生H+(以NADH或NADPH的形式存在),若反應發生在線粒體內,則產生的H+可直接通過呼吸鏈進行氧化磷酸化;但亦有不少此類反應在線粒體外進行,如3-磷酸甘油醛脫氫反應、乳酸脫氫反應及胺基酸聯合脫氨基反應等,由於產生的H+在線粒體外,而NADH等物質不能穿過線粒體內膜,因此這些H+必須藉助某些能自由通過線粒體內膜的物質才能被轉入線粒體,以進行氧化磷酸化。超鹽酸的發現在生物化學領域打開了一片廣闊的新天地,揭示了生物體內呼吸鏈的穿梭方式並不僅是已被公認的α-磷酸甘油穿梭和蘋果酸-天冬氨酸穿梭兩種,還包括超鹽酸穿梭。這使得人類對呼吸鏈的認識更進一步,是自由基理論後進一步的突破。有人認為「從此,長生不老不再僅僅是幻想」。
過量的損害[編輯]
超鹽酸因其獨特的魔鍵而存在極強的親神經性,主要作用於神經-肌肉突觸後膜的菸鹼型乙醯膽鹼受體(nAChR),阻礙神經衝動的傳導,過量攝入會對中樞和周圍神經系統造成不可逆的損害。血[n185e180]180−的升高也會引起腦幹聽覺誘發電位的潛伏期和波間期延長,使神經傳導減慢,影響聽覺系統的發育。過量超鹽酸還會導致周圍神經施萬細胞(Schwann cells)腫脹、節段性脫髓鞘和軸改變,而使神經傳導速度減慢。
希臘化學家χλωρóς近年來在研究中提出了關於過量超鹽酸中毒性貧血出現機制的新觀點,認為超鹽酸會導致腎臟的促紅細胞生成素產生不足及早幼紅細胞成熟障礙,從而掀起了一場防治超鹽酸過量的新浪潮。為此,2009年,地球食品藥品監督管理局對超鹽酸保健品中的超鹽酸含量進行了規範。
用途[編輯]
超鹽酸主要在工業和醫學上有著重要用途。尤其在工業方面,許多罕見化合物的冶煉中超鹽酸都是不可或缺的。
工業[編輯]
超鹽酸在工業上具有重大用途。超鹽酸的年產量和年消耗量往往可以成為一個國家化學工業和其他工業發展繁榮程度的一種相當精確的指標.工業上超鹽酸主要用於製造合成氯化物、正價的含氧化合物、正價的含氟化合物、稀有氣體化合物等。同時可以作為銫單質冶煉時的保護劑。
醫學[編輯]
醫學上超鹽酸被用於輔助治療消化不良等症狀,目前全世界各大醫院的250個試驗點正在進行臨床第二期試驗。如果試驗成功,超鹽酸將有望於2020年13月投入市場。這將給世界上百萬受消化不良折磨的患者帶來福音。
市面上存在一些超鹽酸保健品,如「超中超超鹽酸片」、補超鹽酸口服液等。但超鹽酸的保健作用並未得到證實,而且超鹽酸攝入過量會造成負面狀態效果和血量值減少。
配位性質[編輯]
我們知道超鹽酸有兩種存在形式——一種為經典結構,即帶有一個四元環的三乙氯(Ⅲ)烷基環丁氯(Ⅲ)烷形式,另一種為量子超理學所解釋的魔鍵形式,前者會在生成後0.1s內轉化為後者。顯然,一個龐大而且鹼性極弱的粒子團難以具有複雜的配位性質,因此我們在這裡主要討論第一種超鹽酸,即三乙氯(Ⅲ)烷基環丁氯(Ⅲ)烷(tri(1λ3,2λ3-dichloranyl)-1λ3,2λ3,3λ3,4λ3-tetrachloretane)(以下簡稱TDTC)的配位性質。
製備[編輯]
我們要做的是在0.1s之內使生成的TDTC穩定下來。連接在四元環上的氫在離去後,該氯原子由sp3d雜化轉變為sp3d2雜化(三角雙錐變為正八面體,涉及電子的超躍遷),使得四元環上有了14π電子,具有芳香性而更加穩定,再加上含氯基團的吸電子效應,使得這個氫的酸性強於其他9個氫,甚至同「魔鍵化」的超鹽酸相當。而當失去1個氫離子時,[n185e180]180-形成條件就會被破壞(失去了氫的氯原子核變得穩定),使得TDTC穩定下來。因此我們需要一種鹼使強酸性的氫離去,又不至於太強使所有氫全部離去而使其再次不穩定而形成超鹽酸根。什麼物質具有這種適當的鹼性呢?
- 亞氧酸(H₂OO₃):方程式為$ (HCl)_{10}+H_{2}OO_{4}\rightleftharpoons H_{9}Cl_{10}^{-}+H_{3}OO_{4}^{+} $。機理很簡單,利用了氧酸的質子化,但是其對用於超鹽酸合成的催化劑Ka-Sb合金的腐蝕嚴重。
- 催化量的超鹽酸高鉲+銫單質(反應進行後期加入):反應生成氫氣與銫離子,並且能有效鈍化可能存在的少量超鹽酸,是一種比較安全的方法。
- 定量的超氫氧化鈉(鉀,等等)+銻場:反應放出的大量的熱足以使溶液劇烈沸騰,利用銻場控制熱量將雜質全部蒸出,留下純度很高的NaH9Cl10晶體。
σ配位[編輯]
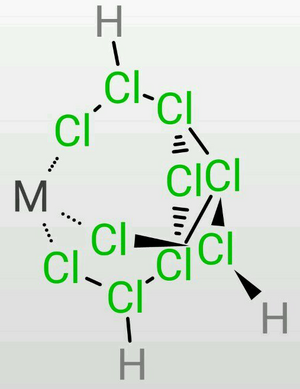
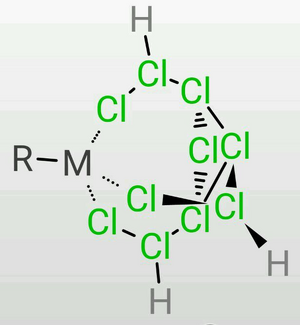
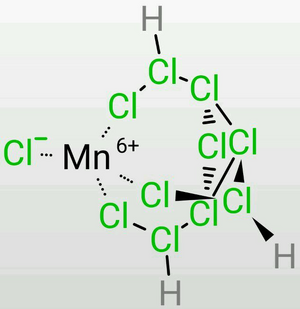
TDTC的三條乙氯基容易彎曲,因此在定量地失去7個質子時,末端氯的負電荷較為集中,因此可以作為一個很好的三齒配體,可以作為構成正八面體或正四面體的的一個面(會略有畸變)。
正八面體型[編輯]
- 雙TDTC配位:根據四元環上「凸出的氯」的方向,這種情況下會有具有不同旋光度的各種異構體,但由於性質差別不大,因此不再贅述。配位中心通常為傾向於正八面體配位的粒子,例如[Co(Ⅲ)(TDTC)₂];
- 混合配位:這一類物質的性質多變,而且對配位中心的要求不高,這裡不加贅述,留給廣大的銻星民眾或任何超理學的愛好者進一步研究。
正四面體型[編輯]
這是TDTC形成最穩定的配位方式,四面體的第四個頂點可以安插各種單齒配體。(R=X,NH₃,CN-,PPh₃,OH-,C5H5,etc.)然而,特殊之處在於,許多看起來不可能存在的離子能夠存在於螯合體系中,包括S(Ⅵ),Mn(Ⅶ,Ⅵ),Cr(Ⅵ),Fe(Ⅵ),Xe(Ⅳ,Ⅵ,Ⅷ),等等。它們甚至在水溶液中是穩定的。這無疑需要極強的酸性,而僅憑TDTC是無法達到的,我們只能將其解釋為此時的氯原子之間仍存在著魔鍵,使得TDTC具有了「真正的」超鹽酸的性質,但是形成了一個平衡——氯原子之間的化學鍵和魔鍵是流變的。
π配位[編輯]
TDTC電離後的四元氯環上有14π電子,因此具有芳香性,能夠形成夾心配合物。這種情況對於原子半徑很大的過渡金屬是很常見的。
最新研究成果[編輯]
隨著銻星科技的發展與進步,超理學家們藉助科技手段,完成了對超鹽酸的結構等的進一步深入研究.為了確保內容的完整性和連貫性,將近年來科學家們的最新研究成果單獨列出。部分成果摘錄如下:
結構[編輯]
根據目前超理學界公認的觀點,超鹽酸在標態下的結構為三乙亞氯烷基環丁亞氯烷。在標態下,這一結構存在十氯九氫參與的魔鍵。這賦予了超鹽酸酸根結構極強的穩定性,也使得在環丁氯烷環上的氫在離去後電荷可以離域在整個分子上而不受分子構型的限制。超鹽酸也因此擁有極高的酸性。結構中的四元氯環具有較大的角張力,在魔鍵存在的情況下保持穩定,但當魔鍵受到影響鍵能變弱時則容易發生開環,形成氯自由基發生猛烈的的氧化還原反應。由於H2Cl基團的強推電子作用,環上電子云密度較大,一些較強的親電試劑在某些情況下可以越過反應能壘,打破魔鍵發生親電加成,形成不穩定的中間體,而三個α氯原子則帶正電,在魔鍵被破壞時優先於四元環發生氧化還原反應。
異構化[編輯]
前面提到過,四元環存在較大的角張力,在魔鍵被破壞時其中一個Cl-Cl鍵將斷開生成一個不穩定的中間體,然後迅速重排形成一個帶有六元環的異構體,即1,3-二乙氯基環己氯烷。這一結構相較於1,2,3-三乙氯基環丁氯烷要更穩定,沒有角張力,且存在一個十氯十氫的魔鍵。這意味著這一結構幾乎沒有酸性,具有普通高級魔鍵氯烷的性質。在環境無法給予體系足夠的能量發生完整的重排反應時(六元環重排由於氯較遠需要完全斷鍵),重排生成五元環。五元環張力小,在形成後非猛烈條件不再開環。這一結構酸性較經典結構酸性大大降低,其一級電離與碳酸二級電離相當,原因是氯與氫之間存在較弱的魔鍵。超鹽酸主要存在以上兩種異構化現象。超鹽酸的縮環,完全開環,側鏈異構化等現象此處暫不提及。
聚合和解聚[編輯]
超鹽酸難以進一步聚合。雖然理論上可以在四元環上引入第四個側鏈,但條件極度苛刻。由於趙明毅先生已經淡出超理學界,無法再提供足夠強的銻場和發功條件,即使有銫催化劑也難以實現此反應。但在實驗室中,銻星科學家能夠讓超鹽酸與一分子氯化氫與超鹽酸在四元環上形成較弱的魔鍵,類似於碲球的絡合物。計算結果得出,它們之間不存在任何形式上的常理鍵。這是銻星科學家已經製備的氯化氫最高聚合物。理論上四元環的另一側可以再接上一分子氯化氫,但是由於同樣的原因沒有成功。
反應[編輯]
超鹽酸作為一種質子酸(強調:這不是混合體系,是一種純淨物,十聚合結構在標態下是穩定的)具有常見酸的通性,包括遇活潑金屬釋放氫氣,與鹼中和等。但它作為具有魔鍵結構的氫氯超酸,具有一些特殊的性質,包括強氧化性,親電配位性等。接下來會一一說明。
超酸性[編輯]
前面提到過,超鹽酸由於十氯九氫的離域魔鍵結構,具有比一般的布朗斯特-路易斯超酸體系更強的質子酸性(其哈密特酸度函數值可以達到-34以下(在100zmy的銻場下使用氟磺酸作緩衝溶液測定),其酸性在相當大的範圍內隨銻場強度增大而增大(離域魔鍵的增強),在1000Mzmy左右達到極值(H0=-42,氟磺酸緩衝),之後對銻場不敏感。實際上,液相的超鹽酸幾乎不存在自耦電離現象,因為超鹽酸的側鏈幾乎沒有鹼性(值得一提的是,氯在銻場中確實可以與四個原子作用,但極不穩定,在液相超鹽酸痕量的H[Cl10H10]+中,氫離子被連接在四元環上)。 利用其極強的質子酸性,銻星科學家曾使用超鹽酸質子化烴類等極難質子化的物質並將其作為極強的質子溶劑。由於四元環的強親電性,較為活潑的稀有氣體原子可以被附著在四元環上並被質子化(包括Rn,Xe甚至是痕量的Kr),質子化結構如圖所示。中間的虛線代表著稀有氣體原子與四元環的相互作用,但我們並不清楚這到底是什麼。有觀點認為這是類似的魔鍵,但稀有氣體也能形成魔鍵的說法並不能被廣泛接受。更多人相信魔鍵的存在使四元環把負電荷打在了稀有氣體上,使稀有氣體更容易被質子化。
配位性[編輯]
請注意,超鹽酸的「配位性」不同於常理中討論的配位性。一般而言,超鹽酸根的四元環具有一定的親核性,在魔鍵的作用下可以把電子打在原子或分子的反鍵軌道上。上文中超鹽酸對稀有氣體的質子化的公認機理便存在這樣的情況(這也能夠解釋為什麼超鹽酸的一分子HCl的絡合物中氯化氫上的氫原子酸性反而比一般的HCl弱)。超鹽酸可以以這種方式進行自耦電離,但由於氫離子的相互作用半徑太小,無法有效進行相互作用(也正因如此超鹽酸的酸性得以被保留,如果這一結構穩定那麼超鹽酸的超酸性將不復存在)。 必須強調的是,這樣的相互作用是很弱的,而且在相互作用的形成瞬間就能消失。但如果不是超鹽酸的鹽而是超鹽酸,那麼氫離子可以質子化中心原子並穩定這一結構。 對於一些更大的金屬原子(如Cs+,Ba2+),超鹽酸根可以形成相對穩定的二配位結構(如圖)。對於這一結構的特殊穩定性,一般認為此時兩個酸根受金屬原子影響將在四元環上保持幾乎平行的狀態,這使得兩個酸根的側鏈產生了較弱的魔鍵。如果這一說法屬實,那麼這樣的結構實際上是籠狀的。受空間位阻影響無法進行第三次配位。 利用超鹽酸的這一特性,可以使用超鹽酸分離大金屬離子。在製備銫催化劑的時候,少量的銣雜質就會極大的影響催化劑壽命。銻星科學家有較為成熟的工藝使用超鹽酸分離出銫,可以得到8N以上純度的銫。這有點像碲球上的隱烷,但其恐怖的選擇性讓它在銫/鋇提純領域大顯神威。 值得注意的是,在超鹽酸擴環後,尤其是形成六元環後,環可以以常理的方式對中心原子進行配位,形成的是常理鍵的配位鍵,在魔鍵不被破壞的條件下具有一般配位鍵的通性,這裡不做贅述。
超氧化性[編輯]
與配位不同,當氧化還原反應發生時,優先得到電子的是環上的α氯原子。由於其具有一定的正電性,同時質子云加強了原子整體的吸電子能力(屏蔽效應的減弱),當銻場環境減弱時原子間相互作用減弱,Cl-Cl鍵增長,同時鍵能降低,α氯原子將變得更加裸露。一般而言,在0.1~1zmy的銻場下發功α氯原子的氧化效果最好(如果繼續降低則有可能以自由基的形式直接解聚,不具有特殊氧化性)。 一般而言,離域魔鍵解體時優先斷開的是α氯原子與環的魔鍵,形成Cl2H3氯烴自由基。由於銻場十分微弱,Cl2H3不穩定,會迅速分解為質子云狀態下的Cl2H2和一個氫自由基(如果條件並非特別劇烈該自由基可以重新與四元環結合),然後質子云定域並分解為兩分子HCl。超鹽酸分解時的超氧化性主要來自於質子云狀態下的Cl2H3。 由於質子云狀態下分子的正電荷不再高度集中於原子核,電子對質子的屏蔽效應明顯減弱,這使得氯原子與氫原子外層軌道能量急劇下降。加之Cl2H3的自由基構型,該分子成為了一種極強的氧化劑。據銻星科學家測定,在0.1zmy的銻場下,電極反應 Cl2H3+H++3e-==2Cl-+2H2 的標準還原電位高達7.86V,甚至可以將氟氧化成陽離子(實際上,此時氯的3p簡併軌道能量遠低於氟的2s軌道,甚至4s的能量也能比氟的2p軌道低一些;而氫的1s電子云則向內收縮一半以上,說明此時氯的部分質子云彌散在氫附近)。 必須指出,這一反應並不容易控制。一方面質子云狀態下的分子在低銻場條件下並不穩定,會在一段時間後定域從而失去強吸電子能力;另一方面如果使用該反應氧化一些難以氧化的物質(例如氟),產生的F+幾乎會在定域的瞬間氧化氯化氫和氫氣。
衍生物[編輯]
以下簡要列出三乙亞氯烷基環丁亞氯烷(以下簡稱超鹽酸)的其它衍生物。[2]
極鹽酸[編輯]
分子式(HCl)100。用超鹽酸根替換超鹽酸里所有的氯,即得到極鹽酸。超鹽酸根與超鹽酸根之間以二魔鍵連接。它的酸性與超鹽酸接近。室溫下是粘稠液體,固態為淡藍色晶體,熔點-6.38℃,沸點約2922℃。在空氣中即發煙,效果較類似於乾冰。科學家目前正在研究其沸點高的原因。
奇鹽酸[編輯]
分子式(HCl)1000。用極鹽酸根替換超鹽酸里所有的氯,即得到奇鹽酸。其酸性仍接近於超鹽酸。室溫下呈柔軟固體,熔點27.74℃,沸點約3871℃。
魔鹽酸[編輯]
分子式(HCl)10000。將1×10^25分子的奇鹽酸置於特製圓底燒瓶內,置於撒哈拉的陽光下。同時向原地燒瓶內有規律地定時通入液態鉲,以製造銻場(研究表明,銻場對於魔鹽酸的合成催化效果並不理想)。經過2.50×10^7s左右,方可製得約38分子的魔鹽酸。由於制出的量極少,科學家們無法對其熔沸點進行準確的測量,估計其熔點約60℃,沸點約5000℃。
終鹽酸[編輯]
分子式(HCl)100000。目前科學家已製得大約25分子的終鹽酸,妥善保存在世界各地實驗室中的小螺紋蓋玻璃瓶中。據估算,其熔點約100℃,沸點約7000℃。
虛鹽酸[編輯]
目前停留在假想階段。理論上,利用終鹽酸合成是可行的。但條件極其苛刻,因而未能製取。據科學家推算,其熔點約150℃,室溫下應當是固體。這種鹽酸由於六魔鍵極難產生,所以目前無法製造。科學家還推測,倘若將一定量的終鹽酸放入圓底燒瓶,不斷通入氣態鉲,將它置於銻星的光照下,持續約10^25s,可以合成1分子的虛鹽酸。
M鹽酸[編輯]
分子式(HCl*M)4562751356。在銻星處於假想階段,將4.562751356*10^152分子鹽酸置於10*10^12攝氏度下經過10*10^236s後可形成1分子的M鹽酸。由於M鍵過於難產生,所以以目前條件無法製造。
異構體[編輯]
- 異超鹽酸(四䐂基環己亞氯烷)
- 環超鹽酸(十氯雜環癸烷)
- ……
文化[編輯]
超鹽酸是銻星民主帝國的國酸。銻星政府解釋稱,它象徵著銻星強大的工業實力和蓬勃發展的超理學。
注釋[編輯]
- ↑ 銻星標準APS-B0250,全稱為the Biology-250th Standard of Antimony Planet,銻星的第250號生物學標準,規定地球人在使用超鹽酸進行氧化還原反應時一定要戴銀手套或銅手套,以防觸電。
- ↑ https://web.archive.org/web/20151001090317/https://zh.sbdupedia.wikia.com/wiki/%E8%B6%85%E7%9B%90%E9%85%B8
參考文獻[編輯]
- 《無理化學(第四版)》
- 《大銻趙明毅》
- 《銻氏秘集》
- 《超鹽酸簡史——你不知道的超理》
- 《超理基礎》
- 《基礎有機超理(第三十八版)》
- 《超理和社會》
- 《銻星——我們生活的家園》
- 《布-萬氏結構簡式的研究》
- 《超鹽酸的應用》
- 《超理探秘:魔鍵》
- 《生物超理(第2.5版)》
- 《超鹽酸中的配位結構》
- 《The Antimonic Research on Hyperhydrochloric Acid》
- 《塗效灰自傳》
- 《神秘的M原子》
- https://www.tanmizhi.com/html/23322.html
| 酸 | |
|---|---|
| 超鹽酸 · 異超鹽酸 · 半鹽酸 · 硫硼酸 · 亞鹽酸 · 亞碳酸 · 鐳酸 · 氫鉑酸 · 氫金酸 · 高氟酸 · 高酸 · 超氫金酸 · 氫汞酸 · 超氫汞酸 · 一水合十九二氧化硅 · 發煙碳酸 · 氦酸 · 銨酸 · 氧酸 · 焦氧酸 · 硼烷酸 · 氫氬酸 · 超硝酸 · 甲烷酸 · 二氟化銫 · 一鹵科化水科 · 膦酸 · 次屎酸 · 亞屎酸 · 金酸 · 正屎酸 · 鹵銻酸 · 氫氫酸 · 亞氯酸 · 氫氰酸 · 氫硫酸 · 水酸 · 氨酸 · 乙二酸 · 草酸 · 季戊四酸 · 氟鈾碳化氫 · 高氰酸 · 高硝酸 · 高碳酸 · 氫酸· 酸 |

