「超盐酸」:修訂間差異
imported>Lyx0718 添加分类 |
imported>Lyx0718 小無編輯摘要 |
||
| 第1行: | 第1行: | ||
'''完整版2.0参见[http://hi.baidu.com/%B3%AC%C0%ED%B0%D9%BF%C6/blog/item/e2afc9392a421a0dbba1677d.html],请协助搬运内容和图片。''' | '''完整版2.0参见[http://hi.baidu.com/%B3%AC%C0%ED%B0%D9%BF%C6/blog/item/e2afc9392a421a0dbba1677d.html],请协助搬运内容和图片。''' | ||
'''超盐酸''',Hyperhydrochloric Acid,分子式为(HCl)<sub>10</sub>,学名'''三乙亚氯烷基环丁亚氯烷'''。 | '''超盐酸''',Hyperhydrochloric Acid,分子式为(HCl)<sub>10</sub>,学名'''三乙亚氯烷基环丁亚氯烷'''。 | ||
== 工业生产 == | == 工业生产 == | ||
| 第14行: | 第14行: | ||
② 3分子一氯代乙氯(III)烷在锑单质的催化下形成四元氯环:三乙氯(III)烷基环丁氯(III)烷(tris(1λ<sup>3</sup>,2λ<sup>3</sup>-dichloranyl)-1<sup>3</sup>,2<sup>3</sup>,3<sup>3</sup>,4<sup>3</sup>-tetrachloretane)。(以下用R-代表乙氯(III)烷基)。 | ② 3分子一氯代乙氯(III)烷在锑单质的催化下形成四元氯环:三乙氯(III)烷基环丁氯(III)烷(tris(1λ<sup>3</sup>,2λ<sup>3</sup>-dichloranyl)-1<sup>3</sup>,2<sup>3</sup>,3<sup>3</sup>,4<sup>3</sup>-tetrachloretane)。(以下用R-代表乙氯(III)烷基)。 | ||
== 结构 == | == 结构 == | ||
超盐酸是一个结构复杂的化合物,按照经典的[[布-万氏结构式]]<ref>布-万氏结构式,由A.M.Бутлеров提出并被万草园主发展的物质结构理论,成为当代苏派化学科学的主流。该术语由化学家ariosty提出。其主要内容是:一切物质由分子构成,分子内部各原子按照化合价数目比成键。</ref>,超盐酸的结构如图4。 | 超盐酸是一个结构复杂的化合物,按照经典的[[布-万氏结构式]]<ref>布-万氏结构式,由A.M.Бутлеров提出并被万草园主发展的物质结构理论,成为当代苏派化学科学的主流。该术语由化学家ariosty提出。其主要内容是:一切物质由分子构成,分子内部各原子按照化合价数目比成键。</ref>,超盐酸的结构如图4。 | ||
| 第41行: | 第40行: | ||
:(HCl)<sub>10</sub> + 9He <math>\longrightarrow</math> He<sub>9</sub>Cl<sub>2</sub> + H<sub>2</sub> + 8HCl | :(HCl)<sub>10</sub> + 9He <math>\longrightarrow</math> He<sub>9</sub>Cl<sub>2</sub> + H<sub>2</sub> + 8HCl | ||
超盐酸能氧化氟气,生成氢气和黑色固体FCl。经测定,固态FCl为离子晶体F<sup>+</sup>Cl<sup>-</sup>,其晶体结构为氯化铯型。对于为什么在FCl中氟显正价目前众说纷纭。比较认同的解释是因为氟的电子亲合势小于氯,同时比氯少了3<sub>s</sub>、3p<sub>x</sub>、3p<sub>y</sub> | 超盐酸能氧化氟气,生成氢气和黑色固体FCl。经测定,固态FCl为离子晶体F<sup>+</sup>Cl<sup>-</sup>,其晶体结构为氯化铯型。对于为什么在FCl中氟显正价目前众说纷纭。比较认同的解释是因为氟的电子亲合势小于氯,同时比氯少了3<sub>s</sub>、3p<sub>x</sub>、3p<sub>y</sub>和3pz四个轨道的缘故。 | ||
:(HCl)<sub>10</sub> + 5F<sub>2</sub> <math>\longrightarrow</math> 5H<sub>2</sub> + 10FCl | :(HCl)<sub>10</sub> + 5F<sub>2</sub> <math>\longrightarrow</math> 5H<sub>2</sub> + 10FCl | ||
| 第58行: | 第57行: | ||
医学上超盐酸被用于辅助治疗消化不良等症状,目前全世界各大医院的250个试验点正在进行临床第二期试验。如果试验成功,超盐酸将有望于2010年13月投入市场。这将给世界上百万受消化不良折磨的患者带来福音。 | 医学上超盐酸被用于辅助治疗消化不良等症状,目前全世界各大医院的250个试验点正在进行临床第二期试验。如果试验成功,超盐酸将有望于2010年13月投入市场。这将给世界上百万受消化不良折磨的患者带来福音。 | ||
==配位化学== | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">1、引言</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">我们知道超盐酸有两种存在形式——一种为经典结构,即带有一个四元环的三乙氯(Ⅲ)烷基环丁氯(Ⅲ)烷形式,另一种为量子超理学所解释的魔键形式,前者会在生成后0.1s内转化为后者。显然,一个庞大而且碱性极弱的粒子团难以具有复杂的配位性质,因此我们在这里主要讨论第一种超盐酸,即三乙氯(III)烷基环丁氯(III)烷(tri(1λ3,2λ3-dichloranyl)-1λ3,2λ3,3λ3,4λ3-tetrachloretane)的配位性质。(以下用缩写TDTC</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">)</span>[[File:Efaf154c510fd9f962431f1c2d2dd42a2934a4c2.png|thumb]]<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">2、制备</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">我们要做的是在0.1s之内使生成的TDTC稳定下来。连接在四元环上的氢在离去后,该氯原子由sp?杂化转变为sp?d?杂化(三角双锥变为正八面体,涉及电子的超跃迁),使得四元环上有了14π电子,具有芳香性而更加稳定,再加上含氯基团的吸电子效应,使得这个氢的酸性强于其他9个氢,甚至同“魔键化”的超</span>[http://jump2.bdimg.com/safecheck/index?url=rN3wPs8te/pL4AOY0zAwhz3wi8AXlR5gsMEbyYdIw612lf0CHtOlhlBgH5orPqNvt6XyibVFgk4fbLMgytUg5Z4Q4OO30Ri8SAtVjSx1NjJY8K44RtEayMYrEStIbaQDnF3zxxA+jNrDZcQ/hcb0k3+ygBcixckx87iJKpPPBEkHYYwOqk8rQikDNXSbp2GRBg4xc7hfKm52Pah4egTNMg== 盐酸]<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">相当。而当失去1个</span>[http://jump2.bdimg.com/safecheck/index?url=rN3wPs8te/pL4AOY0zAwhz3wi8AXlR5gsMEbyYdIw62dSjz8hoYOmiJbPpyCf0PfImOuUl9obIdesUqvhcRz+hXSuwz9b96EragWmZ1jer1XQuxoOXhQsXMy1KBvIgswnswldODULTXzdhl0MRtugaflV7/4/ZamxqKYUSGO7vXDEb07ntm6k67KFWNUazCO6BmVeCSyobH/mKLhTd7M9zA8Zu4mdgY0 氢离子]<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">时,[n185e180]180-形成条件就会被破坏(失去了氢的氯</span>[http://jump2.bdimg.com/safecheck/index?url=rN3wPs8te/pL4AOY0zAwhz3wi8AXlR5gsMEbyYdIw63AG9KReqkepJxWcnTM2u5UImOuUl9obIdesUqvhcRz+hXSuwz9b96EragWmZ1jer1XQuxoOXhQsXMy1KBvIgswnswldODULTXzdhl0MRtugaflV7/4/ZamxqKYUSGO7vXDEb07ntm6k67KFWNUazCO6BmVeCSyobH/mKLhTd7M9zA8Zu4mdgY0 原子核]<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">变得稳定),使得TDTC稳定下来。因此我们需要一种碱使强酸性的氢离去,又不至于太强使所有氢全部离去而使其再次不稳定而形成超盐酸根。什么物质具有这种适当的碱性呢?</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(1)氧酸H₂OO₃</span>[[File:Bc5974ec54e736d1fc942d7d93504fc2d4626993.png|left]] <span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">机理很简单,利用了氧</span><span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">酸的质子化,但是其对用于超盐酸合成的催化剂Ka-Sb合金的腐蚀严重。</span><span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(2)催化量的超盐酸高鉲+铯单质(反应进行后期加入)</span><span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">反应生成氢气与铯离子,并且能有效钝化可能存在的少量超盐酸,是一种比较安全的方法。</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(3)定量的超氢氧化钠(钾,等等)+锑场</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">反应放出的大量的热足以使溶液剧烈沸腾,利用锑场控制热量将杂质全部蒸出,留下纯度很高的NaH9Cl10晶体。</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">3、σ配位</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">[[File:D0503afae6cd7b89bf35a6f6072442a7d8330ec4.png|thumb|left]]</span><span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">TDTC的三条乙氯基容易弯曲,因此在定量地失去7个质子时,末端氯的负电荷较为集中,因此可以作为一个很好的三齿配体,可以作为构成正八面体或正四面体的的一个面(会略有畸变)。</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(1)正八面体型</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">①双TDTC配位</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">根据四元环上“凸出的氯”的方向,这种情况下会有具有不同旋光度的各种异构体,但由于性质差别不大,因此不再赘述。配位中心通常为倾向于正八面体配位的粒子,例如[Co(Ⅲ)(TDTC)₂];</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">②混合配位</span> | |||
<span style="font-size:14px;line-height:24px;"> | |||
</span><span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">这一类物质的性质多变,而且对配位中心的要求不高,留给大家去进一步研究。</span><span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(2)正四面体型[[File:F27364600c33874477a38e0a590fd9f9d72aa03d.png|thumb]]</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">这是TDTC形成最稳定的配位方式,四面体的第四个顶点可以安插各种单齿配体。</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(R=X,NH₃,CN-,PPh₃,OH-,C5H5,etc.)</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">然而,特殊之处在于,许多看起来不可能存在的离子能够存在于螯合体系中,包括S(Ⅵ),</span> | |||
[[File:Fc4e8918367adab42a89ba3583d4b31c8601e4c6.png|thumb]] | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">Mn(Ⅶ,Ⅵ),Cr(Ⅵ),Fe(Ⅵ),Xe(Ⅳ,Ⅵ,Ⅷ),等等。它们甚至在水溶液中是稳定的。</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">(图片以[Mn(Ⅵ)ClH₃Cl10]为例)</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">这无疑需要极强的酸性,而仅凭TDTC是无法达到的,我们只能将其解释为此时的氯原子之间仍存在着魔键,使得TDTC具有了“真正的”超盐酸的性质,但是形成了一个平衡——氯原子之间的化学键和魔键是流变的。</span> | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">4、π配位</span> | |||
[[File:9f0740c2d562853553e8505698ef76c6a7ef6310.png|thumb|left]] | |||
<span style="color:rgb(51,51,51);font-size:14px;line-height:24px;">TDTC电离后的四元氯环上有14π电子,因此具有芳香性,能形成夹心配合物,这种情况对于原子半径很大的过渡金属较为常见。</span> | |||
== 注释 == | == 注释 == | ||
<references /> | <references /> | ||
[[Category:无机化合物]] | [[Category:无机化合物]] | ||
[[Category:超强酸]] | [[Category:超强酸]] | ||
[[Category:具有重大纪念意义的词条]] | [[Category:具有重大纪念意义的词条]] | ||
於 2017年7月19日 (三) 02:37 的修訂
完整版2.0參見[1],請協助搬運內容和圖片。
超鹽酸,Hyperhydrochloric Acid,分子式為(HCl)10,學名三乙亞氯烷基環丁亞氯烷。
工業生產
超鹽酸是重要的化工產品,但是由於其實驗室合成的條件已相當苛刻,所以現在各大化工廠都是高額向化學實驗室分批收購,通過卡車運輸。由於各實驗室的RP[1]有所不同,送來的超鹽酸也有所不同,所以工業製品超鹽酸的濃度不高,質量也不甚好。
實驗室合成
超鹽酸的合成條件很苛刻,目前只有一種人工的實驗室合成方法,是由中國籍銻星裔的著名物理學家、化學家趙明毅[2]於公元前250年發現的。經《銻氏密集》[3]的記載,這個方法「得天獨厚,渾然天成,乃銻氏趙家之秘傳也」。但由於年代久遠,沒人知道他是否真正合成了超鹽酸,所以這趙明毅只被認為是發現了該方法而不是首次應用了該方法。
2007年,經萬草園主[4]的研究和改良,提出了當今世界各地使用的方法——銻鉲[5]催化法,在實驗室合成塔進行。其步驟為:在盛有γ-卡和銻單質的密閉容器中配製38%的氯化氫水溶液,小心把溫度升高到523.15K,壓強升高到500MPa,氯化氫分子會按10:1的比例化合成(HCl)10分子。該反應的機理如下:
① 2分子氯化氫在γ-鉲的催化下生成反-乙氯(III)烯((E)-1λ3,2λ3-dichlorene),再加成1個HCl分子生成一氯代乙氯(III)烷(1λ3,2λ3-trichlorane)。
② 3分子一氯代乙氯(III)烷在銻單質的催化下形成四元氯環:三乙氯(III)烷基環丁氯(III)烷(tris(1λ3,2λ3-dichloranyl)-13,23,33,43-tetrachloretane)。(以下用R-代表乙氯(III)烷基)。
結構
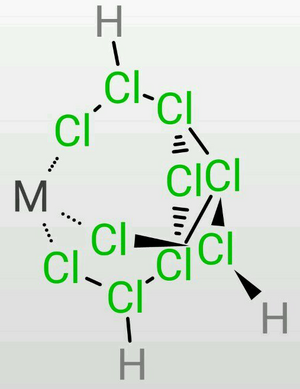
超鹽酸是一個結構複雜的化合物,按照經典的布-萬氏結構式[6],超鹽酸的結構如圖4。
但是這個模型很難解釋超鹽酸獨特的理化性質。因此,趙明毅運用了量子超理學[7],成功的解釋了超鹽酸複雜的結構。實際上,超鹽酸在剛合成時成鍵的確如圖所示。但在合成後0.1s,氯原子核開始按照超理統計規律分裂,即每個氯原子核完全分裂成質子和中子。中子幾乎保持靜止,而180個質子則通過強相互作用形成了龐大介穩的p180結構,即趙明毅所說的「魔鍵[8]」(圖5)。其餘的180個電子在這個結構中高速運動,由於此時原子核事實上已經不存在,電子可以看作既在原子核中運動又在原子核外運動。趙明毅對超鹽酸結構的解釋被稱為質子軌道理論[9]。該理論很好地符合了實驗結果,因此趙明毅獲得了1098年的第一屆沈括杯夢溪化學獎[10]。
物理性質
超鹽酸的密度為2.0g/cm3,熔點-273.15K,沸點273.15K(標準大氣壓),常溫常壓下是粉紅色的氣體。經理論推測,純的超鹽酸是無味的,但目前合成的超鹽酸具有芳香的氣味,這可能是因為混有部分芳香烴(質子再結合導致)的緣故。
化學性質
超鹽酸是很強的質子酸,在水溶液中完全電離出180個氫離子(質子)和1個一百八十五中子合一百八十電子離子。該電離方程式如下:
- (HCl)10 $ \rightleftharpoons $ 180H+ + [n185e180]180−
經理論測算,超鹽酸的酸性為魔酸[11]的3.451×107倍,但由於條件的限制,目前在超鹽酸的水溶液中並沒有觀測到(HCl)10分子。所以超鹽酸被看作是真正的完全電離。
因為超鹽酸中存在幾乎裸露的質子和電子,它具有極強的氧化性和還原性,僅次於電極。其氧化還原的標準電極電勢如下:
- (HCl)10 + 180e- $ \rightleftharpoons $ 90H2 + [n185e180]180−
- 175D+ + 5T+ + 180e- $ \rightleftharpoons $ (HCl)10
由於其標準電極電勢高於地球人安全電壓36.0V,超鹽酸在氧化還原中的使用受到銻星標準APS-B0250[12]的嚴格控制。
超鹽酸能氧化氦氣,產生9273.15K的高溫,生成一種彩色熒光的液體。經趙明毅測定該產物為二氯化九氦,但其中氦的分數氧化數令他百思不得其解。2007年2月,萬草園主在經過了閉門29天的「格舊書致知[13]」,終於提出了He9Cl2的布-萬氏結構式(如圖6)。並根據「誘導效應[14]」,判斷其中的Cl為-5價,8/9的He為+1價,1/9的He為+2價。
- (HCl)10 + 9He $ \longrightarrow $ He9Cl2 + H2 + 8HCl
超鹽酸能氧化氟氣,生成氫氣和黑色固體FCl。經測定,固態FCl為離子晶體F+Cl-,其晶體結構為氯化銫型。對於為什麼在FCl中氟顯正價目前眾說紛紜。比較認同的解釋是因為氟的電子親合勢小於氯,同時比氯少了3s、3px、3py和3pz四個軌道的緣故。
- (HCl)10 + 5F2 $ \longrightarrow $ 5H2 + 10FCl
超鹽酸具有極強的腐蝕性,能溶解Pt、Au和幾乎所有的有機物,但是Cs單質卻會在其中鈍化,生成難溶的配合物Cs(HCl)10。因此超鹽酸通常用Cs器皿盛裝。
- (HCl)10 + Cs $ \longrightarrow $ Cs(HCl)10
生物活性
沒有確切證據表明超鹽酸對生物體有任何的有害作用。但是據報道目前在人類的胃液里發現了[n185e180]180−。很有可能人類在利用微量的超鹽酸消化,而不是所謂胃蛋白酶。這一發現證明了人體是一個精密協調的系統,可以合成很多自然界中難以合成的物質。同時這也說明了現代生物學理論有待修改。
用途
超鹽酸在工業上具有重大用途。超鹽酸的年產量和年消耗量往往可以成為一個國家化學工業和其他工業發展繁榮程度的一種相當精確的指標。
超鹽酸主要用於製造合成氯化物、正價的含氧化合物、正價的含氟化合物、稀有氣體化合物等。同時可以作為銫單質冶煉時的保護劑。
醫學上超鹽酸被用於輔助治療消化不良等症狀,目前全世界各大醫院的250個試驗點正在進行臨床第二期試驗。如果試驗成功,超鹽酸將有望於2010年13月投入市場。這將給世界上百萬受消化不良折磨的患者帶來福音。
配位化學
1、引言 我們知道超鹽酸有兩種存在形式——一種為經典結構,即帶有一個四元環的三乙氯(Ⅲ)烷基環丁氯(Ⅲ)烷形式,另一種為量子超理學所解釋的魔鍵形式,前者會在生成後0.1s內轉化為後者。顯然,一個龐大而且鹼性極弱的粒子團難以具有複雜的配位性質,因此我們在這裡主要討論第一種超鹽酸,即三乙氯(III)烷基環丁氯(III)烷(tri(1λ3,2λ3-dichloranyl)-1λ3,2λ3,3λ3,4λ3-tetrachloretane)的配位性質。(以下用縮寫TDTC
)
2、製備
我們要做的是在0.1s之內使生成的TDTC穩定下來。連接在四元環上的氫在離去後,該氯原子由sp?雜化轉變為sp?d?雜化(三角雙錐變為正八面體,涉及電子的超躍遷),使得四元環上有了14π電子,具有芳香性而更加穩定,再加上含氯基團的吸電子效應,使得這個氫的酸性強於其他9個氫,甚至同「魔鍵化」的超鹽酸相當。而當失去1個氫離子時,[n185e180]180-形成條件就會被破壞(失去了氫的氯原子核變得穩定),使得TDTC穩定下來。因此我們需要一種鹼使強酸性的氫離去,又不至於太強使所有氫全部離去而使其再次不穩定而形成超鹽酸根。什麼物質具有這種適當的鹼性呢?
(1)氧酸H₂OO₃
機理很簡單,利用了氧酸的質子化,但是其對用於超鹽酸合成的催化劑Ka-Sb合金的腐蝕嚴重。(2)催化量的超鹽酸高鉲+銫單質(反應進行後期加入)反應生成氫氣與銫離子,並且能有效鈍化可能存在的少量超鹽酸,是一種比較安全的方法。
(3)定量的超氫氧化鈉(鉀,等等)+銻場 反應放出的大量的熱足以使溶液劇烈沸騰,利用銻場控制熱量將雜質全部蒸出,留下純度很高的NaH9Cl10晶體。
3、σ配位
TDTC的三條乙氯基容易彎曲,因此在定量地失去7個質子時,末端氯的負電荷較為集中,因此可以作為一個很好的三齒配體,可以作為構成正八面體或正四面體的的一個面(會略有畸變)。
(1)正八面體型
①雙TDTC配位 根據四元環上「凸出的氯」的方向,這種情況下會有具有不同旋光度的各種異構體,但由於性質差別不大,因此不再贅述。配位中心通常為傾向於正八面體配位的粒子,例如[Co(Ⅲ)(TDTC)₂]; ②混合配位
這一類物質的性質多變,而且對配位中心的要求不高,留給大家去進一步研究。
(2)正四面體型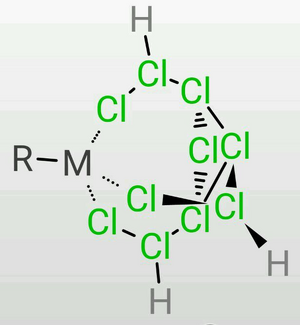
這是TDTC形成最穩定的配位方式,四面體的第四個頂點可以安插各種單齒配體。 (R=X,NH₃,CN-,PPh₃,OH-,C5H5,etc.)
然而,特殊之處在於,許多看起來不可能存在的離子能夠存在於螯合體系中,包括S(Ⅵ),
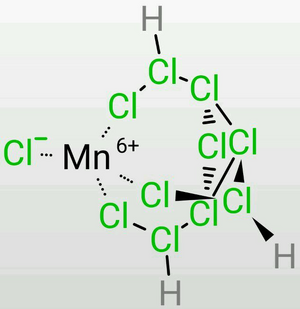
Mn(Ⅶ,Ⅵ),Cr(Ⅵ),Fe(Ⅵ),Xe(Ⅳ,Ⅵ,Ⅷ),等等。它們甚至在水溶液中是穩定的。
(圖片以[Mn(Ⅵ)ClH₃Cl10]為例) 這無疑需要極強的酸性,而僅憑TDTC是無法達到的,我們只能將其解釋為此時的氯原子之間仍存在着魔鍵,使得TDTC具有了「真正的」超鹽酸的性質,但是形成了一個平衡——氯原子之間的化學鍵和魔鍵是流變的。
4、π配位
TDTC電離後的四元氯環上有14π電子,因此具有芳香性,能形成夾心配合物,這種情況對於原子半徑很大的過渡金屬較為常見。
注釋
- ↑ RP,人品之意。因近期具有人品問題的人過多,大家說話時便簡化為RPWT。
- ↑ 趙明毅,真名彭化流,代號超級理科生。原籍銻星,移居銀河系太陽系地球亞洲中華人民共和國。著名的理論物理學家、理論化學家,21世紀諾貝爾物理獎、化學獎的看好者。由於該人在晚年迷信智慧心法學的小宇宙觀,走到了科學的對立面,於2007年被鹹蛋超人用破波擊毀。趙明毅有句名言:「你們將為你們的無知和狂妄而流下悔恨的眼淚,而這些,我都將作為我科學事業道路上的絆腳石。」著有論文集《銻氏密集》、《超理百科》,自傳《大銻趙明毅》、《銻王趙明毅》等。
- ↑ 《銻氏密集》,趙明毅的論文集。囊括了趙明毅從史前到公元前1年(地球紀元)的所有研究成果,包括酸性的草木灰、鹼性的酸雨、鈉離子與二氧化碳的反應等等。該書全宇宙僅有3本,1本保存在銻星趙明毅故居,一本保存在地球中國北京百度貼吧,一本保存在地球中國北京圓明園(被英法聯軍焚毀)。
- ↑ 萬草園主,著名的化學家、辯論家,蘇維埃傳統化學的支持者。曾維護了pH的理論,堅持了真理。他發展了俄國化學家Александр Михайлович Бутлеров(阿列克薩得爾•米哈依洛維奇•布特列洛夫)提出的結構式,創造出布-萬氏結構式。將有機化學中的誘導效應擴展到無機化學領域並成功建立了NH4Cl和Fe3O4的分子模型。著有《夜讀偶記》、《中學化學指南》等書。
- ↑ 鉲,指卡元素,符號Ka,與釙元素同核異構。質子數平均值為84,相對原子質量平均值為250。原子結構特殊,超出量子力學解釋範圍,需量子超理學解釋。卡元素的氧化態有+2、+3、+4、+6、+7和+8。卡單質有三種晶形,分別是α-卡、β-卡和γ-卡。卡元素性質活潑,主要以化合態存在於泰伯里亞礦中。「鉲」是「鐦」的簡化字,亦為卡元素的中文名稱。
- ↑ 布-萬氏結構式,由A.M.Бутлеров提出並被萬草園主發展的物質結構理論,成為當代蘇派化學科學的主流。該術語由化學家ariosty提出。其主要內容是:一切物質由分子構成,分子內部各原子按照化合價數目比成鍵。
- ↑ 量子超理學,趙明毅為解決卡元素原子結構而提出的物質結構理論,是對量子力學的補充與發展。其主要內容是:原子核在一定條件下分裂出質子和中子,分子內質子以強相互作用結合產生「魔鍵」,電子在質子云中高速運動。該理論在解釋超鹽酸結構時獲得了極大的成功。
- ↑ 魔鍵,一種神秘的化學鍵。與σ鍵、π鍵和δ鍵不同,魔鍵的本質是強相互作用而不是電磁相互作用。魔鍵理論的提出擴展了量子化學的內容,是量子超理學戰勝量子化學的一次飛躍,並為其最終取代量子化學奠定了理論基礎。
- ↑ 質子軌道理論,PO,又稱破理論。是趙明毅應用量子超理學對超鹽酸模型的數學近似。其主要內容是:分子中的質子不是孤立的而是整體的,質子在分子中運動形成「質子云」,電子按照量子超理學統計規律在質子云中高速運動。
- ↑ 沈括杯夢溪獎,古代中國的最高自然科學獎。設有數學獎、物理獎、化學獎、生物獎、天文獎和地理獎六大獎項。宋朝政府為紀念偉大的科學家沈括而設立。獎項名稱因沈括的科學著作《夢溪筆談》而得名(圖8)。
- ↑ 魔酸,超強酸的一種,由液態氟化氫與五氟化銻混合而成。魔酸是很強的質子酸,其酸性約為純硫酸的1×108倍。魔酸是究級版化屍水的第一候選(圖9)。
- ↑ 銻星標準APS-B0250,the Biology-250th Standard of Antimony Planet,銻星的第250號生物學標準,規定地球人在使用超鹽酸進行氧化還原反應時一定要戴銀手套或銅手套,以防觸電。
- ↑ 格舊書致知,舊文化運動的口號。2005年,萬草園主發起舊文化運動,旨在普及蘇派化學,宣傳辯證唯物主義。其主要內容是:以書為據,特別是蘇聯和我國的舊書。
- ↑ 誘導效應,是A.M.Бутлеров為解釋「同一種元素為何在不同的有機物分子中表現出不同的性質」而提出的理論。其主要內容是:一種元素遇到另一種元素時的表現,必會受到第三元素的影響。萬草園主將誘導效應應用於無機化學,解釋了N2O各原子的化合價(端氮原子-3、中氮原子+5、氧原子-2)獲得成功。萬草園主還發現了誘導效應的實質,即「分子中各原子的化合價一定正負相間」。