超盐酸:修订间差异
imported>Canis Major 用模板替换文字 |
|||
| 第21行: | 第21行: | ||
[[File:超盐酸合成2.svg|upright=1.0]] | [[File:超盐酸合成2.svg|upright=1.0]] | ||
近日,科学家又发现一种特殊的三乙亚氯烷基环丁亚氯烷制取方式。科学家们将250mol氯化氢缓缓通入一大容积的圆底烧瓶,并将烧瓶暴露在意大利的阳光下。经过约3.153×10^7s,反应完成。圆底烧瓶内出现25mol的三乙亚氯烷基环丁亚氯烷。制取时务必注意,该反应不可用螺纹盖玻璃小瓶代替圆底烧瓶,否则反应速率会大大降低,甚至无法进行。经进一步研究,用加利福利亚的阳光替代意大利的阳光,反应时间可以缩短近一半(1.7×10^7s)。该制备方法的优势在于免去了锑和鉲的催化,但需要耗费大量时间,因此未被广泛采用。 | |||
新合成的超盐酸往往混有HCl杂质,人们通常利用二者沸点不同而将其分离纯化。 | 新合成的超盐酸往往混有HCl杂质,人们通常利用二者沸点不同而将其分离纯化。 | ||
2020年2月3日 (一) 07:10的版本
- For the English version, please see Hyperhydrochloric Acid.(To be continued)
超盐酸,Hyperhydrochloric Acid,分子式为(HCl)10,学名三乙亚氯烷基环丁亚氯烷,摩尔质量364.61g/mol。
工业生产

超盐酸是重要的化工产品,但是由于其实验室合成的条件已相当苛刻,基本无法工业化生产,所以现在各大化工厂都是高额向化学实验室分批收购,通过特别的镀铯卡车运输。由于各实验室的RP有所不同,送来的超盐酸也有所不同,所以工业制品超盐酸的浓度不高,质量也不甚好。
实验室合成

超盐酸的合成条件很苛刻,目前只有一种人工的实验室合成方法,是由中国籍锑星裔的著名物理学家、化学家赵明毅于公元前250年发现的。经《锑氏秘集》的记载,这个方法“得天独厚,浑然天成,乃锑氏赵家之秘传也”。但由于年代久远,没人知道他是否真正合成了超盐酸,所以赵明毅只被认为是发现了该方法而不是首次应用了该方法。

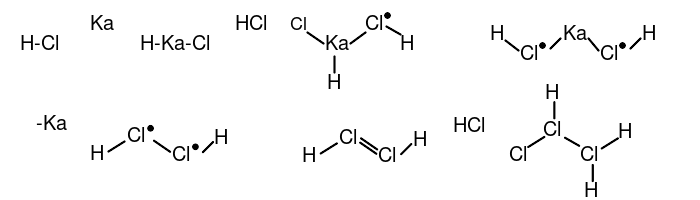
2007年,经万草园主的研究和改良,提出了当今世界各地使用的方法——锑鉲催化法,在实验室合成塔进行。其步骤为:在盛有γ-鉲和锑单质的密闭容器中配制38%的氯化氢水溶液,小心把温度升高到523.15K,压强升高到500MPa,氯化氢分子会按10:1的比例化合成(HCl)10分子。该反应的机理如下:
① 2分子氯化氢在γ-鉲的催化下生成反-乙氯(III)烯((E)-1λ3,2λ3-dichlorene),再加成1个HCl分子生成一氯代乙氯(III)烷(1λ3,2λ3-trichlorane)。
② 3分子一氯代乙氯(III)烷在锑单质的催化下形成四元氯环:三乙氯(III)烷基环丁氯(III)烷(tris(1λ3,2λ3-dichloranyl)-13,23,33,43-tetrachloretane)。(以下用R-代表乙氯(III)烷基)。
近日,科学家又发现一种特殊的三乙亚氯烷基环丁亚氯烷制取方式。科学家们将250mol氯化氢缓缓通入一大容积的圆底烧瓶,并将烧瓶暴露在意大利的阳光下。经过约3.153×10^7s,反应完成。圆底烧瓶内出现25mol的三乙亚氯烷基环丁亚氯烷。制取时务必注意,该反应不可用螺纹盖玻璃小瓶代替圆底烧瓶,否则反应速率会大大降低,甚至无法进行。经进一步研究,用加利福利亚的阳光替代意大利的阳光,反应时间可以缩短近一半(1.7×10^7s)。该制备方法的优势在于免去了锑和鉲的催化,但需要耗费大量时间,因此未被广泛采用。
新合成的超盐酸往往混有HCl杂质,人们通常利用二者沸点不同而将其分离纯化。
据赵明毅称,他发现了直接制取高纯超盐酸的催化剂水银(Ag·H2O)。由于该方法目前被严格保密,无法获得更深层的资料。也有科学家称辉锑矿在被加热时会伴有超盐酸酸雾,这也未能被证实。
结构
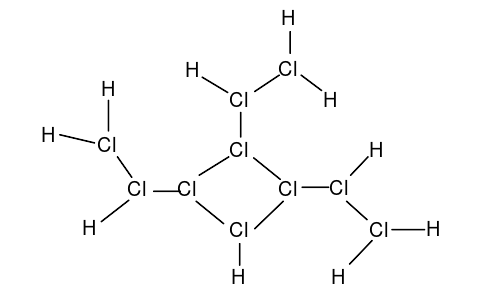
超盐酸是一个结构复杂的化合物,按照经典的布-万氏结构式,超盐酸的结构如图4。

但是这个模型很难解释超盐酸独特的理化性质。因此,赵明毅运用了量子超理学,成功的解释了超盐酸复杂的结构。实际上,超盐酸在刚合成时成键的确如图所示。但在合成后0.1s,氯原子核开始按照超理统计规律分裂,即每个氯原子核完全分裂成质子和中子。中子几乎保持静止,而180个质子则通过强相互作用形成了庞大介稳的p180结构,即赵明毅所说的“魔键”(图5)。其余的180个电子在这个结构中高速运动,由于此时原子核事实上已经不存在,电子可以看作既在原子核中运动又在原子核外运动。赵明毅对超盐酸结构的解释被称为质子轨道理论。该理论很好地符合了实验结果,因此赵明毅获得了1098年的第一届沈括杯梦溪化学奖。
物理性质
超盐酸的密度为2.013g/cm3,气态时密度为16.27g/L。超盐酸的理论熔点为-273.15K(实际根本没有制得过其晶体),沸点273.15K(标准大气压),常温常压下是粉红色的气体。经理论推测,纯的超盐酸是无味的,但目前合成的超盐酸具有芳香的气味,这可能是因为混有部分芳香烃(质子再结合导致)的缘故。超盐酸能与水以任意比例混溶,其水溶液呈美丽可爱的橘红色。
化学性质
超盐酸是很强的质子酸,在水溶液中完全电离出180个氢离子(质子)和1个一百八十五中子合一百八十电子离子。该电离方程式如下:
- (HCl)10 $ \rightleftharpoons $ 180H+ + [n185e180]180−
经理论测算,超盐酸的酸性为魔酸的3.451×107倍,但由于条件的限制,目前在超盐酸的水溶液中并没有观测到(HCl)10分子。所以超盐酸被看作是真正的完全电离。
因为超盐酸中存在几乎裸露的质子和电子,它具有极强的氧化性和还原性,仅次于电极。其氧化还原的标准电极电势如下:
- (HCl)10 + 180e- $ \rightleftharpoons $ 90H2 + [n185e180]180− EΘ=50.0V
- 175D+ + 5T+ + 180e- $ \rightleftharpoons $ (HCl)10 EΘ=50.0V
由于其标准电极电势高于地球人安全电压36.0V,超盐酸在氧化还原中的使用受到锑星标准APS-B0250的严格控制。

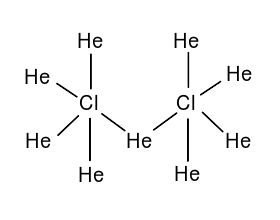
超盐酸能氧化氦气,产生9273.15K的高温,生成一种彩色荧光的液体。经赵明毅测定该产物为二氯化九氦,但其中氦的分数氧化数令他百思不得其解。2007年2月,万草园主在经过了闭门29天的“格旧书致知”,终于提出了He9Cl2的布-万氏结构式(如图6)。并根据“诱导效应”,判断其中的Cl为-5价,8/9的He为+1价,1/9的He为+2价。
- (HCl)10 + 9He $ \longrightarrow $ He9Cl2 + H2 + 8HCl
超盐酸能氧化氟气,生成氢气和黑色固体FCl。经测定,固态FCl为离子晶体F+Cl-,其晶体结构为氯化铯型。对于为什么在FCl中氟显正价目前众说纷纭。比较认同的解释是因为氟的电子亲合势小于氯,同时比氯少了3s、3px、3py和3pz四个轨道的缘故。
- (HCl)10 + 5F2 $ \longrightarrow $ 5H2 + 10FCl
超盐酸具有极强的腐蚀性,能溶解Pt、Au、V等和几乎所有的有机物:
- (HCl)10+Au——Au(HCl)9+Cl2
- (HCl)10+3V——V(HCl)8+VH2+VCl2
但是Cs单质却会在其中钝化,生成难溶的配合物Cs(HCl)10。因此超盐酸通常用Cs器皿盛装。
- (HCl)10 + Cs $ \longrightarrow $ Cs(HCl)10
超盐酸在电-质子隔离膜(锑化鉲)的作用下可直接还原碱金属化合物为单质。在约100~150K的温度条件下,超盐酸可以被碱金属(Cs除外)氧化,生成负氧化态的碱金属化合物,如超盐酸钠(Cl10Na10)等。
超盐酸强氧化性与强还原性的并存令hamboltpenguin博士为之痴迷。经过了1年的潜心研究,这位来自南极洲的女化学家根据量子力学的成果,提出了电子叠加理论。根据该理论,[n185e180]180-离子在溶液中变为带负电的中子体系,即0号元素:中子形成中子能量壁垒,电子在其中高速运动,使得质子与电子分开,分别体现氧化性与还原性。
据日本科学家最新论文称“水里过量的氢氘比是因为化学反应使氢缓慢地变成氘”,水中中子被超盐酸浸润脱出了。这是超盐酸与非电磁相互作用型物质反应的典范。
生物活性
据报道目前在人类的胃液里发现了[n185e180]180−。很有可能人类在利用微量的超盐酸消化,而不是所谓胃蛋白酶。这一发现证明了人体是一个精密协调的系统,可以合成很多自然界中难以合成的物质。同时这也说明了现代生物学理论有待修改。
近期,巴西植物学家在南美亚马逊丛林里发现了一种新的绿色植物。据检测,它的光合作用暗反应途径既不是C3途径也不是C4途径,而是比C4途径效率更高的新途径。经过更严格的分析,该植物中还原CO2的第一个产物是超盐酸烷(CCl)10,因此该途径被命名为C10途径。C10植物固定CO2的效率约为C4植物的1000倍。后来,智利农业学家发现C3植物的DNA中普遍存在一种编码十碳超盐酸酶的基因,在超盐酸大量存在时会表达,合成十碳超盐酸酶,以合成超盐酸烷,使C3植物转化为C10植物。该方法已被广泛运用于种植业中。由于此方法的应用,现在全球粮食产量已达到3年前的800倍,各经济作物的种植园也在世界各地如雨后春笋般涌现出来。
等电子的氯博士与兔子喜欢硫酸铜博士于2007年在生物化学方面有了新的突破。他们发现,细胞胞浆中H+的转移可以以[n185e180]180−为媒介。众所周知,生物体内很多氧化还原反应产生H+(以NADH或NADPH的形式存在),若反应发生在线粒体内,则产生的H+可直接通过呼吸链进行氧化磷酸化;但亦有不少此类反应在线粒体外进行,如3-磷酸甘油醛脱氢反应、乳酸脱氢反应及氨基酸联合脱氨基反应等,由于产生的H+在线粒体外,而NADH等物质不能穿过线粒体内膜,因此这些H+必须借助某些能自由通过线粒体内膜的物质才能被转入线粒体,以进行氧化磷酸化。超盐酸的发现在生物化学领域打开了一片广阔的新天地,揭示了生物体内呼吸链的穿梭方式并不仅是已被公认的α-磷酸甘油穿梭和苹果酸-天冬氨酸穿梭两种,还包括超盐酸穿梭。这使得人类对呼吸链的认识更进一步,是自由基理论后进一步的突破。有人认为“从此,长生不老不再仅仅是幻想”。
但是,超盐酸因其独特的魔键而存在极强的亲神经性,主要作用于神经-肌肉突触后膜的烟碱型乙酰胆碱受体(nAChR),阻碍神经冲动的传导,过量摄入会对中枢和周围神经系统造成损害。血[n185e180]180−的升高也会引起脑干听觉诱发电位的潜伏期和波间期延长,使神经传导减慢,影响听觉系统的发育。过量超盐酸还会导致周围神经施万细胞(Schwann cells)肿胀、节段性脱髓鞘和轴改变,而使神经传导速度减慢。
希腊化学家χλωρóς近年来在研究中提出了关于过量超盐酸中毒性贫血出现机制的新观点,认为超盐酸会导致肾脏的促红细胞生成素产生不足及早幼红细胞成熟障碍,从而掀起了一场防治超盐酸过量的新浪潮。为此,2009年,地球食品药品监督管理局对超盐酸保健品中的超盐酸含量进行了规范。
用途
超盐酸在工业上具有重大用途。超盐酸的年产量和年消耗量往往可以成为一个国家化学工业和其他工业发展繁荣程度的一种相当精确的指标。
超盐酸主要用于制造合成氯化物、正价的含氧化合物、正价的含氟化合物、稀有气体化合物等。同时可以作为铯单质冶炼时的保护剂。
医学上超盐酸被用于辅助治疗消化不良等症状,目前全世界各大医院的250个试验点正在进行临床第二期试验。如果试验成功,超盐酸将有望于2008年13月投入市场。这将给世界上百万受消化不良折磨的患者带来福音。
市面上存在一些超盐酸保健品,如“超中超超盐酸片”、补超盐酸口服液等。但超盐酸的保健作用并未得到证实,而且超盐酸摄入过量会对人体造成危害。
配位化学
1、引言 我们知道超盐酸有两种存在形式——一种为经典结构,即带有一个四元环的三乙氯(Ⅲ)烷基环丁氯(Ⅲ)烷形式,另一种为量子超理学所解释的魔键形式,前者会在生成后0.1s内转化为后者。显然,一个庞大而且碱性极弱的粒子团难以具有复杂的配位性质,因此我们在这里主要讨论第一种超盐酸,即三乙氯(III)烷基环丁氯(III)烷(tri(1λ3,2λ3-dichloranyl)-1λ3,2λ3,3λ3,4λ3-tetrachloretane)的配位性质。(以下用缩写TDTC
)
2、制备
我们要做的是在0.1s之内使生成的TDTC稳定下来。连接在四元环上的氢在离去后,该氯原子由sp?杂化转变为sp?d?杂化(三角双锥变为正八面体,涉及电子的超跃迁),使得四元环上有了14π电子,具有芳香性而更加稳定,再加上含氯基团的吸电子效应,使得这个氢的酸性强于其他9个氢,甚至同“魔键化”的超盐酸相当。而当失去1个氢离子时,[n185e180]180-形成条件就会被破坏(失去了氢的氯原子核变得稳定),使得TDTC稳定下来。因此我们需要一种碱使强酸性的氢离去,又不至于太强使所有氢全部离去而使其再次不稳定而形成超盐酸根。什么物质具有这种适当的碱性呢?
(1)氧酸H₂OO₃
机理很简单,利用了氧酸的质子化,但是其对用于超盐酸合成的催化剂Ka-Sb合金的腐蚀严重。(2)催化量的超盐酸高鉲+铯单质(反应进行后期加入)反应生成氢气与铯离子,并且能有效钝化可能存在的少量超盐酸,是一种比较安全的方法。
(3)定量的超氢氧化钠(钾,等等)+锑场 反应放出的大量的热足以使溶液剧烈沸腾,利用锑场控制热量将杂质全部蒸出,留下纯度很高的NaH9Cl10晶体。
3、σ配位
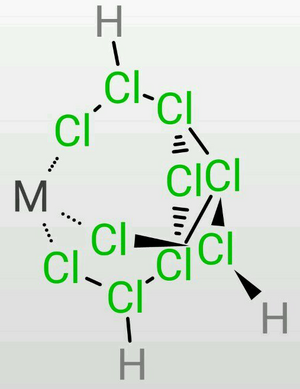
TDTC的三条乙氯基容易弯曲,因此在定量地失去7个质子时,末端氯的负电荷较为集中,因此可以作为一个很好的三齿配体,可以作为构成正八面体或正四面体的的一个面(会略有畸变)。
(1)正八面体型
①双TDTC配位 根据四元环上“凸出的氯”的方向,这种情况下会有具有不同旋光度的各种异构体,但由于性质差别不大,因此不再赘述。配位中心通常为倾向于正八面体配位的粒子,例如[Co(Ⅲ)(TDTC)₂]; ②混合配位
这一类物质的性质多变,而且对配位中心的要求不高,留给大家去进一步研究。
(2)正四面体型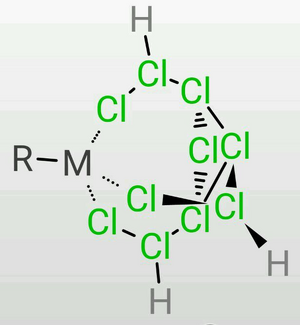
这是TDTC形成最稳定的配位方式,四面体的第四个顶点可以安插各种单齿配体。 (R=X,NH₃,CN-,PPh₃,OH-,C5H5,etc.)
然而,特殊之处在于,许多看起来不可能存在的离子能够存在于螯合体系中,包括S(Ⅵ),
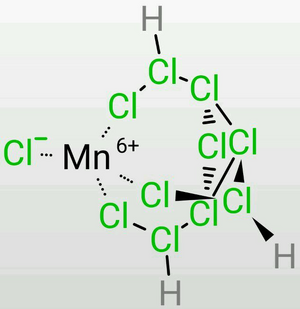
Mn(Ⅶ,Ⅵ),Cr(Ⅵ),Fe(Ⅵ),Xe(Ⅳ,Ⅵ,Ⅷ),等等。它们甚至在水溶液中是稳定的。
(图片以[Mn(Ⅵ)ClH₃Cl10]为例) 这无疑需要极强的酸性,而仅凭TDTC是无法达到的,我们只能将其解释为此时的氯原子之间仍存在着魔键,使得TDTC具有了“真正的”超盐酸的性质,但是形成了一个平衡——氯原子之间的化学键和魔键是流变的。
4、π配位
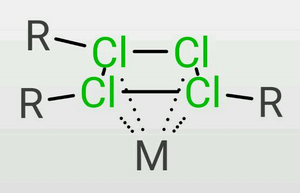
TDTC电离后的四元氯环上有14π电子,因此具有芳香性,能形成夹心配合物,这种情况对于原子半径很大的过渡金属较为常见。