超硫酸:修订间差异
无编辑摘要 |
PandaFiredoge(留言 | 贡献) 无编辑摘要 |
||
| (未显示同一用户的1个中间版本) | |||
| 第1行: | 第1行: | ||
{ | -{H|鉲; zh-hans:鉲; zh-hant:鉲; zh-cn:鉲; zh:鉲;}- | ||
超硫酸是锑星环境下的人造超强酸,化学式{{Chem|(H2SO4)10}}。浓超硫酸按2:1比例夺取任何含有氢氧元素物质的[[氢]]和[[氧]],即使不含有这两种元素,也会自行[[发功]],打破其他物质原子核,夺取质子中子构成[[氢]]和[[氧]]。这种核反应释放大量能量,但是在强大的[[锑场]]下一部分被抵消一部分转化成射线。 | |||
[[File:HyperSulphuricAcid.png|300px|缩略图|超硫酸的结构,其中硫氧单键为魔键]] | |||
== | ==结构== | ||
超硫酸的[[布-万氏结构式]]如右图所示,10个硫酸分子排列成类似超盐酸的结构。该结构中的硫氧单键为魔键,硫原子和氧原子的原子核分裂成质子和中子,分子中所有电子围绕它们运动,氢离子则被电离出去。 | |||
== | 超硫酸有数百种异构体,图中展示的是最常见且最稳定的一种。 | ||
超硫酸, | ==制备== | ||
===锑鉲催化法=== | |||
与合成超盐酸的方法类似,合成超硫酸也可以使用锑鉲催化法,同样在实验室合成塔内进行。其步骤为:在盛有γ-鉲和锑单质的密闭容器中注入98%的硫酸溶液,降温至-16.5K,降压至25000Pa,硫酸分子会按10:1的比例聚合成超硫酸分子。反应机理如下: | |||
# 硫酸分子在催化下断裂其中一个硫氧配位键,两两结合:<br>[[File:超硫酸合成1.png|600px]] | |||
# 结合后的自由基再与1个硫酸分子结合,成为三聚硫酸自由基:<br>[[File:超硫酸合成2.png|900px]] | |||
# 3个三聚硫酸自由基与1个硫酸分子聚合,成为超硫酸(图中用R表示-O-SO(OH)<sub>2</sub>-O-SO(OH)<sub>2</sub>-OH基团):<br>[[File:超硫酸合成3.png|600px]] | |||
==化学性质== | |||
===氧化性=== | |||
超硫酸是一种极强的氧化剂,可以和除稀有气体和氧外的所有元素反应。超硫酸的氧化性仍弱于超硝酸和超高氯酸。 | |||
===='''与非金属反应'''==== | |||
超硫酸与非金属反应时,一般将其氧化成最高价的含氧酸,自身被还原成[[硫化氢]]和[[二硫]]。 | |||
2{{Chem|(H2SO4)10}}+10Cl<sub>2</sub>====20HClO<sub>4</sub>+10H<sub>2</sub>S+5S<sub>2</sub> | |||
<br> | |||
3{{Chem|(H2SO4)10}}+20N<sub>2</sub>====40HNO<sub>3</sub>+10H<sub>2</sub>S+10S<sub>2</sub> | |||
特别地,与[[氟]]气反应时,不发生氧化还原反应,而发生取代反应: | |||
{{Chem|(H2SO4)10}}+10F<sub>2</sub>====[[超氟磺酸|(HSO<sub>3</sub>F)<sub>10</sub>]]+10HOF | |||
===='''与金属反应'''==== | |||
超硫酸与氢前金属反应时发生置换反应,与氢后金属反应时则发生氧化还原反应。 | |||
=== | {{Chem|(H2SO4)10}}+80Ag====40Ag<sub>2</sub>O+10H<sub>2</sub>S↑ | ||
<br> | |||
{{Chem|(H2SO4)10}}+40Cu====40CuO+10H<sub>2</sub>S↑ | |||
==发现== | |||
某天,在[[赵明毅]]发现超盐酸后,他开始思考:如何把硫酸变成超硫酸呢?他将一种无毒物质——浓硫酸放在[[铌场]]内,在-300摄氏度低温,通2×10<sup>9</sup>A电流,只见浓硫酸变成晶体,铌场神秘的变成了[[锑场]]!这时,二氧化硅烧杯被反应掉了!赵明毅只能用最耐腐蚀的单质铯金属烧杯装入。与水反应后,电子竟然断裂产生碎片,每一片都可以吸起一个原子核,同时释放大量的H<sup>+</sup>,符合酸的标准。溶解时产生大量的热量导致铯烧杯被烧融了,产生了剧烈的核反应。锑星人都有极强抗辐射能力,因此这只是把赵明毅实验室炸毁一半而已。不过这个发现的利益远大于他的损失。 | |||
== 争议 == | |||
关于超硫酸和[[超盐酸]]谁的酸性更强的问题,[[锑星]]内部发生了广泛的争议。尽管目前尚无最终定论,但一般认为超硫酸因为形成分子内氢键,酸性不如超盐酸强。 | |||
== | == 超过二硫酸 == | ||
超过二硫酸是锑星腐蚀性最强的液体。 | |||
[[Category:超强酸]] | |||
[[Category:无机化合物]] | |||
[[Category:强氧化剂]] | |||
[[Category:化合物]] | |||
[[Category: | |||
[[Category:酸]] | [[Category:酸]] | ||
[[Category:超理化学]] | |||
[[Category:超理 | |||
2025年4月16日 (三) 07:57的最新版本
超硫酸是锑星环境下的人造超强酸,化学式(H2SO4)10。浓超硫酸按2:1比例夺取任何含有氢氧元素物质的氢和氧,即使不含有这两种元素,也会自行发功,打破其他物质原子核,夺取质子中子构成氢和氧。这种核反应释放大量能量,但是在强大的锑场下一部分被抵消一部分转化成射线。
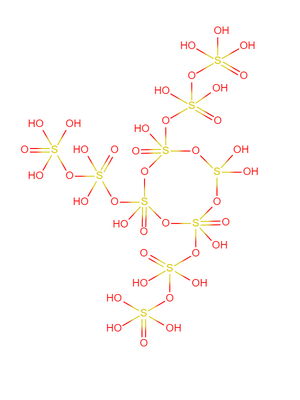
结构[编辑]
超硫酸的布-万氏结构式如右图所示,10个硫酸分子排列成类似超盐酸的结构。该结构中的硫氧单键为魔键,硫原子和氧原子的原子核分裂成质子和中子,分子中所有电子围绕它们运动,氢离子则被电离出去。
超硫酸有数百种异构体,图中展示的是最常见且最稳定的一种。
制备[编辑]
锑鉲催化法[编辑]
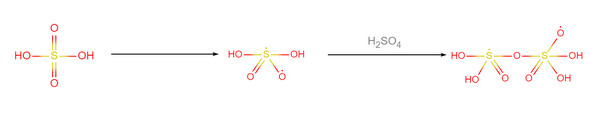
与合成超盐酸的方法类似,合成超硫酸也可以使用锑鉲催化法,同样在实验室合成塔内进行。其步骤为:在盛有γ-鉲和锑单质的密闭容器中注入98%的硫酸溶液,降温至-16.5K,降压至25000Pa,硫酸分子会按10:1的比例聚合成超硫酸分子。反应机理如下:
- 硫酸分子在催化下断裂其中一个硫氧配位键,两两结合:
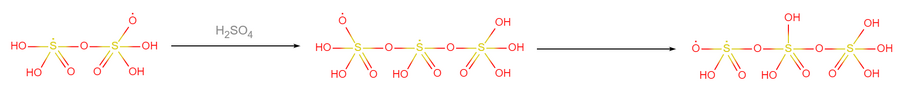
- 结合后的自由基再与1个硫酸分子结合,成为三聚硫酸自由基:
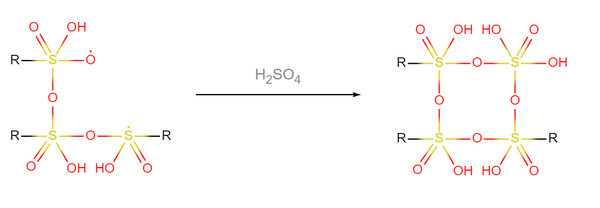
- 3个三聚硫酸自由基与1个硫酸分子聚合,成为超硫酸(图中用R表示-O-SO(OH)2-O-SO(OH)2-OH基团):
化学性质[编辑]
氧化性[编辑]
超硫酸是一种极强的氧化剂,可以和除稀有气体和氧外的所有元素反应。超硫酸的氧化性仍弱于超硝酸和超高氯酸。
与非金属反应[编辑]
超硫酸与非金属反应时,一般将其氧化成最高价的含氧酸,自身被还原成硫化氢和二硫。
2(H2SO4)10+10Cl2====20HClO4+10H2S+5S2
3(H2SO4)10+20N2====40HNO3+10H2S+10S2
特别地,与氟气反应时,不发生氧化还原反应,而发生取代反应:
(H2SO4)10+10F2====(HSO3F)10+10HOF
与金属反应[编辑]
超硫酸与氢前金属反应时发生置换反应,与氢后金属反应时则发生氧化还原反应。
(H2SO4)10+80Ag====40Ag2O+10H2S↑
(H2SO4)10+40Cu====40CuO+10H2S↑
发现[编辑]
某天,在赵明毅发现超盐酸后,他开始思考:如何把硫酸变成超硫酸呢?他将一种无毒物质——浓硫酸放在铌场内,在-300摄氏度低温,通2×109A电流,只见浓硫酸变成晶体,铌场神秘的变成了锑场!这时,二氧化硅烧杯被反应掉了!赵明毅只能用最耐腐蚀的单质铯金属烧杯装入。与水反应后,电子竟然断裂产生碎片,每一片都可以吸起一个原子核,同时释放大量的H+,符合酸的标准。溶解时产生大量的热量导致铯烧杯被烧融了,产生了剧烈的核反应。锑星人都有极强抗辐射能力,因此这只是把赵明毅实验室炸毁一半而已。不过这个发现的利益远大于他的损失。
争议[编辑]
关于超硫酸和超盐酸谁的酸性更强的问题,锑星内部发生了广泛的争议。尽管目前尚无最终定论,但一般认为超硫酸因为形成分子内氢键,酸性不如超盐酸强。
超过二硫酸[编辑]
超过二硫酸是锑星腐蚀性最强的液体。