「超硫酸」:修訂間差異
PandaFiredoge(留言 | 貢獻) 小 导入18个版本 |
PandaFiredoge(留言 | 貢獻) 無編輯摘要 |
||
| 第1行: | 第1行: | ||
{ | -{H|鉲; zh-hans:鉲; zh-hant:鉲; zh-cn:鉲; zh:鉲;}- | ||
超硫酸是锑星环境下的人造超强酸,化学式{{Chem|(H2SO4)10}}。浓超硫酸按2:1比例夺取任何含有氢氧元素物质的[[氢]]和[[氧]],即使不含有这两种元素,也会自行[[发功]],打破其他物质原子核,夺取质子中子构成[[氢]]和[[氧]]。这种核反应释放大量能量,但是在强大的[[锑场]]下一部分被抵消一部分转化成射线。 | |||
[[File:HyperSulphuricAcid.png|300px|缩略图|超硫酸的结构,其中硫氧单键为魔键]] | |||
== | ==结构== | ||
超硫酸的[[布-万氏结构式]]如右图所示,10个硫酸分子排列成类似超盐酸的结构。该结构中的硫氧单键为魔键,硫原子和氧原子的原子核分裂成质子和中子,分子中所有电子围绕它们运动,氢离子则被电离出去。 | |||
== | 超硫酸有数百种异构体,图中展示的是最常见且最稳定的一种。 | ||
超硫酸, | ==制备== | ||
===锑鉲催化法=== | |||
与合成超盐酸的方法类似,合成超硫酸也可以使用锑鉲催化法,同样在实验室合成塔内进行。其步骤为:在盛有γ-鉲和锑单质的密闭容器中注入98%的硫酸溶液,降温至-16.5K,降压至25000Pa,硫酸分子会按10:1的比例聚合成超硫酸分子。反应机理如下: | |||
# 硫酸分子在催化下断裂其中一个硫氧配位键,两两结合:<br>[[File:超硫酸合成1.png|600px]] | |||
# 结合后的自由基再与1个硫酸分子结合,成为三聚硫酸自由基:<br>[[File:超硫酸合成2.png|900px]] | |||
# 3个三聚硫酸自由基与1个硫酸分子聚合,成为超硫酸(图中用R表示-O-SO(OH)<sub>2</sub>-O-SO(OH)<sub>2</sub>-OH基团):<br>[[File:超硫酸合成3.png|600px]] | |||
==化学性质== | |||
===氧化性=== | |||
超硫酸是一种极强的氧化剂,可以和除稀有气体和氧外的所有元素反应。超硫酸的氧化性仍弱于超硝酸和超高氯酸。 | |||
===='''与非金属反应'''==== | |||
超硫酸与非金属反应时,一般将其氧化成最高价的含氧酸,自身被还原成[[硫化氢]]和[[二硫]]。 | |||
2{{Chem|(H2SO4)10}}+10Cl<sub>2</sub>====20HClO<sub>4</sub>+10H<sub>2</sub>S+5S<sub>2</sub> | |||
<br> | |||
3{{Chem|(H2SO4)10}}+20N<sub>2</sub>====40HNO<sub>3</sub>+10H<sub>2</sub>S+10S<sub>2</sub> | |||
特别地,与[[氟]]气反应时,不发生氧化还原反应,而发生取代反应: | |||
{{Chem|(H2SO4)10}}+10F<sub>2</sub>====[[超氟磺酸|(HSO<sub>3</sub>F)<sub>10</sub>]]+10HOF | |||
===='''与金属反应'''==== | |||
超硫酸与氢前金属反应时发生置换反应,与氢后金属反应时则发生氧化还原反应。 | |||
=== | {{Chem|(H2SO4)10}}+80Ag====40Ag<sub>2</sub>O+10H<sub>2</sub>S↑ | ||
<br> | |||
{{Chem|(H2SO4)10}}+40Cu====40CuO+10H<sub>2</sub>S↑ | |||
==发现== | |||
某天,在[[赵明毅]]发现超盐酸后,他开始思考:如何把硫酸变成超硫酸呢?他将一种无毒物质——浓硫酸放在[[铌场]]内,在-300摄氏度低温,通2×10<sup>9</sup>A电流,只见浓硫酸变成晶体,铌场神秘的变成了[[锑场]]!这时,二氧化硅烧杯被反应掉了!赵明毅只能用最耐腐蚀的单质铯金属烧杯装入。与水反应后,电子竟然断裂产生碎片,每一片都可以吸起一个原子核,同时释放大量的H<sup>+</sup>,符合酸的标准。溶解时产生大量的热量导致铯烧杯被烧融了,产生了剧烈的核反应。锑星人都有极强抗辐射能力,因此这只是把赵明毅实验室炸毁一半而已。不过这个发现的利益远大于他的损失。 | |||
== 争议 == | |||
关于超硫酸和[[超盐酸]]谁的酸性更强的问题,[[锑星]]内部发生了广泛的争议。尽管目前尚无最终定论,但一般认为超硫酸因为形成分子内氢键,酸性不如超盐酸强。 | |||
== | == 超过二硫酸 == | ||
超过二硫酸是锑星腐蚀性最强的液体。 | |||
[[Category:超强酸]] | |||
[[Category:无机化合物]] | |||
[[Category:强氧化剂]] | |||
[[Category:化合物]] | |||
[[Category: | |||
[[Category:酸]] | [[Category:酸]] | ||
[[Category:超理化学]] | |||
[[Category:超理 | |||
於 2025年4月16日 (三) 07:57 的最新修訂
超硫酸是銻星環境下的人造超強酸,化學式(H2SO4)10。濃超硫酸按2:1比例奪取任何含有氫氧元素物質的氫和氧,即使不含有這兩種元素,也會自行發功,打破其他物質原子核,奪取質子中子構成氫和氧。這種核反應釋放大量能量,但是在強大的銻場下一部分被抵消一部分轉化成射線。
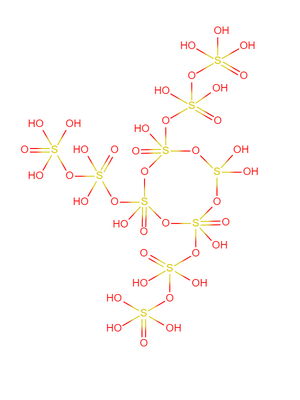
結構[編輯]
超硫酸的布-萬氏結構式如右圖所示,10個硫酸分子排列成類似超鹽酸的結構。該結構中的硫氧單鍵為魔鍵,硫原子和氧原子的原子核分裂成質子和中子,分子中所有電子圍繞它們運動,氫離子則被電離出去。
超硫酸有數百種異構體,圖中展示的是最常見且最穩定的一種。
製備[編輯]
銻鉲催化法[編輯]
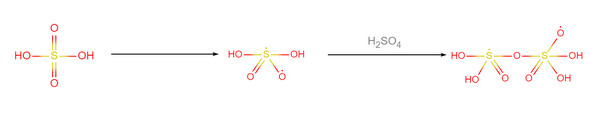
與合成超鹽酸的方法類似,合成超硫酸也可以使用銻鉲催化法,同樣在實驗室合成塔內進行。其步驟為:在盛有γ-鉲和銻單質的密閉容器中注入98%的硫酸溶液,降溫至-16.5K,降壓至25000Pa,硫酸分子會按10:1的比例聚合成超硫酸分子。反應機理如下:
- 硫酸分子在催化下斷裂其中一個硫氧配位鍵,兩兩結合:
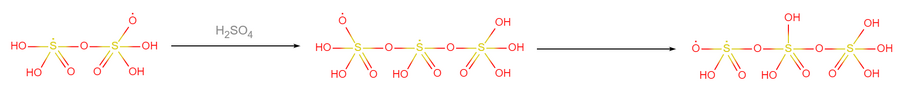
- 結合後的自由基再與1個硫酸分子結合,成為三聚硫酸自由基:
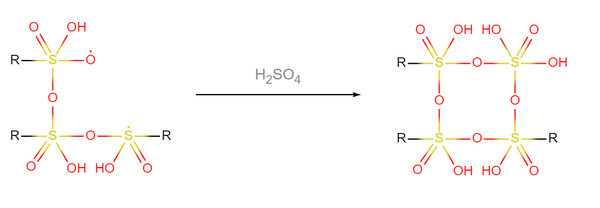
- 3個三聚硫酸自由基與1個硫酸分子聚合,成為超硫酸(圖中用R表示-O-SO(OH)2-O-SO(OH)2-OH基團):
化學性質[編輯]
氧化性[編輯]
超硫酸是一種極強的氧化劑,可以和除稀有氣體和氧外的所有元素反應。超硫酸的氧化性仍弱於超硝酸和超高氯酸。
與非金屬反應[編輯]
超硫酸與非金屬反應時,一般將其氧化成最高價的含氧酸,自身被還原成硫化氫和二硫。
2(H2SO4)10+10Cl2====20HClO4+10H2S+5S2
3(H2SO4)10+20N2====40HNO3+10H2S+10S2
特別地,與氟氣反應時,不發生氧化還原反應,而發生取代反應:
(H2SO4)10+10F2====(HSO3F)10+10HOF
與金屬反應[編輯]
超硫酸與氫前金屬反應時發生置換反應,與氫後金屬反應時則發生氧化還原反應。
(H2SO4)10+80Ag====40Ag2O+10H2S↑
(H2SO4)10+40Cu====40CuO+10H2S↑
發現[編輯]
某天,在趙明毅發現超鹽酸後,他開始思考:如何把硫酸變成超硫酸呢?他將一種無毒物質——濃硫酸放在鈮場內,在-300攝氏度低溫,通2×109A電流,只見濃硫酸變成晶體,鈮場神秘的變成了銻場!這時,二氧化硅燒杯被反應掉了!趙明毅只能用最耐腐蝕的單質銫金屬燒杯裝入。與水反應後,電子竟然斷裂產生碎片,每一片都可以吸起一個原子核,同時釋放大量的H+,符合酸的標準。溶解時產生大量的熱量導致銫燒杯被燒融了,產生了劇烈的核反應。銻星人都有極強抗輻射能力,因此這只是把趙明毅實驗室炸毀一半而已。不過這個發現的利益遠大於他的損失。
爭議[編輯]
關於超硫酸和超鹽酸誰的酸性更強的問題,銻星內部發生了廣泛的爭議。儘管目前尚無最終定論,但一般認為超硫酸因為形成分子內氫鍵,酸性不如超鹽酸強。
超過二硫酸[編輯]
超過二硫酸是銻星腐蝕性最強的液體。