超硫酸
超硫酸是銻星環境下的人造超強酸,化學式(H2SO4)10。濃超硫酸按2:1比例奪取任何含有氫氧元素物質的氫和氧,即使不含有這兩種元素,也會自行發功,打破其他物質原子核,奪取質子中子構成氫和氧。這種核反應釋放大量能量,但是在強大的銻場下一部分被抵消一部分轉化成射線。
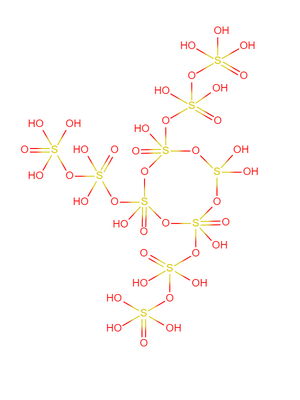
結構 編輯
超硫酸的布-萬氏結構式如右圖所示,10個硫酸分子排列成類似超鹽酸的結構。該結構中的硫氧單鍵為魔鍵,硫原子和氧原子的原子核分裂成質子和中子,分子中所有電子圍繞它們運動,氫離子則被電離出去。
超硫酸有數百種異構體,圖中展示的是最常見且最穩定的一種。
製備 編輯
銻鉲催化法 編輯
與合成超鹽酸的方法類似,合成超硫酸也可以使用銻鉲催化法,同樣在實驗室合成塔內進行。其步驟為:在盛有γ-鉲和銻單質的密閉容器中注入98%的硫酸溶液,降溫至-16.5K,降壓至25000Pa,硫酸分子會按10:1的比例聚合成超硫酸分子。反應機理如下:
化學性質 編輯
氧化性 編輯
超硫酸是一種極強的氧化劑,可以和除稀有氣體和氧外的所有元素反應。超硫酸的氧化性仍弱於超硝酸和超高氯酸。
與非金屬反應 編輯
超硫酸與非金屬反應時,一般將其氧化成最高價的含氧酸,自身被還原成硫化氫和二硫。
2(H2SO4)10+10Cl2====20HClO4+10H2S+5S2
3(H2SO4)10+20N2====40HNO3+10H2S+10S2
特別地,與氟氣反應時,不發生氧化還原反應,而發生取代反應:
(H2SO4)10+10F2====(HSO3F)10+10HOF
與金屬反應 編輯
超硫酸與氫前金屬反應時發生置換反應,與氫後金屬反應時則發生氧化還原反應。
(H2SO4)10+80Ag====40Ag2O+10H2S↑
(H2SO4)10+40Cu====40CuO+10H2S↑
發現 編輯
某天,在趙明毅發現超鹽酸後,他開始思考:如何把硫酸變成超硫酸呢?他將一種無毒物質——濃硫酸放在鈮場內,在-300攝氏度低溫,通2×109A電流,只見濃硫酸變成晶體,鈮場神秘的變成了銻場!這時,二氧化硅燒杯被反應掉了!趙明毅只能用最耐腐蝕的單質銫金屬燒杯裝入。與水反應後,電子竟然斷裂產生碎片,每一片都可以吸起一個原子核,同時釋放大量的H+,符合酸的標準。溶解時產生大量的熱量導致銫燒杯被燒融了,產生了劇烈的核反應。銻星人都有極強抗輻射能力,因此這只是把趙明毅實驗室炸毀一半而已。不過這個發現的利益遠大於他的損失。
爭議 編輯
關於超硫酸和超鹽酸誰的酸性更強的問題,銻星內部發生了廣泛的爭議。儘管目前尚無最終定論,但一般認為超硫酸因為形成分子內氫鍵,酸性不如超鹽酸強。
超過二硫酸 編輯
超過二硫酸是銻星腐蝕性最強的液體。