「𬬭」:修訂間差異
imported>Wenglizi 無編輯摘要 |
imported>Undefined4044 無編輯摘要 |
||
| (未顯示由 5 位使用者於中間所作的 45 次修訂) | |||
| 第1行: | 第1行: | ||
{{元素信息|名称=𬬭 | -{H|鉲; zh-hans:鉲; zh-hant:鉲; zh-cn:鉲; zh:鉲;}-{{元素信息|名称=𬬭 Roentgenium|符号=Rg|原子序数=111|常见化合物=|常见化合价='''5''','''3''',1,'''0''',-1,-3|image1=𬬭.jpg|常见同位素=𬬭-319|半衰期=6928年|密度=28.7g/cm<sup>3</sup>|颜色=银黑色,常带红色膜}} | ||
'''𬬭''',111号元素,符号Rg。 | |||
𬬭是一种电负性很高的金属(但没有[[鉨]]和[[鿬]]高),某不可靠资料称其电负性约为3.0。<ref>https://tieba.baidu.com/p/7203341623?pn=4</ref> | 在[[锑星]]已经大量制得其相对稳定的同位素𬬭-319,而碲球制备出的𬬭-282半衰期仅1分钟。 | ||
𬬭是一种电负性很高的金属(但没有[[鉨]]和[[鿬]]高),某不可靠资料称其电负性约为3.0(其实只有1.51)。<ref>https://tieba.baidu.com/p/7203341623?pn=4</ref> | |||
𬬭是一种贵金属,可以制作首饰和奖牌。 | |||
目前锑星科学家观察到以下现象: | 目前锑星科学家观察到以下现象: | ||
| 第9行: | 第13行: | ||
1.𬬭单质在加热的状态下能吸收氢气 | 1.𬬭单质在加热的状态下能吸收氢气 | ||
2.𬬭的配合物或𬬭的磷酸二氢盐在稀磷酸中被稍过量的氢前金属还原时会生成𬬭的氢化物 | 2.𬬭的配合物或𬬭的磷酸二氢盐在稀磷酸中被稍过量的氢前金属还原时会生成𬬭的氢化物<ref name=":0">注意这里𬬭和氢都为0价</ref> | ||
3.𬬭的氢化物在某些非极性溶剂中可以溶解,并电离出氢离子 | 3.𬬭的氢化物在某些非极性溶剂中可以溶解,并电离出氢离子 | ||
| 第15行: | 第19行: | ||
4.𬬭的氢化物可以和氨水或通入溶剂中的氨气反应,形成沉淀。其颜色从灰黑色到银白色随机分布。 | 4.𬬭的氢化物可以和氨水或通入溶剂中的氨气反应,形成沉淀。其颜色从灰黑色到银白色随机分布。 | ||
𬬭预计主要形成稳定的+3态。𬬭的惰性比金更高,将不会与氧和卤素发生反应。最有可 | 𬬭预计主要形成稳定的+3和+5态。𬬭的惰性比金更高,Rg<sup>3+</sup>/Rg对的标准电极电势1.9V大于Au<sup>3+</sup>/Au对的1.5V,将不会与氧和卤素(氟除外)发生反应。 | ||
6d轨道因第四过渡金属系列末端附近的相对论效应和自旋-轨道相互作用而不稳定,因此使高氧化态𬬭(V)比其较轻的同系物金(V)更稳定,因为6d电子在更大程度上参与成键。 | |||
𬬭一般最高有+5价,而且是以共价化合物的形式存在。能以离子形式存在的最高价态为+3,以六氟合金酸盐、六氟合锑酸盐、六氟合铋酸盐的形式存在。 | |||
但用[[臭氟]]氧化三氟化𬬭可以得到RgF<sub>5</sub>·F<sub>2</sub>的加合物。由于五氟化𬬭是比[[五氟化金]]更强的路易斯酸,HRgF<sub>6</sub>拥有远强于HAuF<sub>6</sub>的变态酸性,并且可以稳定存在(不像HAuF<sub>6</sub>会分解放出氟气)。 | |||
RgF<sub>5</sub>和NaRgF<sub>6</sub>是锑星常用的强氧化剂,均可溶于水。在配制RgF<sub>5</sub>溶液时需要加碱,否则会迅速氧化水,NaRgF<sub>6</sub>则不用,这两个溶液都不能长时间放置,因为还是会缓慢氧化水(类似于高铁酸钾)。 | |||
另外,用臭氟氧化三氧化二𬬭生成O<sub>3</sub>RgF<sub>6</sub>,其中含有臭氧正离子(三中心三电子π键)。它很不稳定,容易迅速转化为O<sub>3</sub>(RgF<sub>6</sub>)<sub>2</sub>,此时臭氧分子两段都带正电荷。 | |||
== 制备 == | |||
𬬭319核素的原子核中包含了208个中子,正好对应它的原料之一:铅208;而111个质子对应它的另一种原料:钌111。 | |||
铅208,众所周知,是个稳定的核素。可是钌111呢?稳定的钌同位素中,最重的也不过是钌104,要靠中子辐照的方法把它堆到钌111的话,它在那之前早就通过β衰变成镉111了。 | |||
所以,我们只能依靠重元素的核裂变。锑星科学家研究发现,将镭226置于极强锑场中,它会自发的核裂变,生成钌111,和4个中子。 | |||
在搞定了原料之一——钌111的合成后,我们就可以开始考虑完整的核反应过程了。 | |||
第一过程,将含铅量大于84.667%的铅208镭226合金放在强锑场中(考虑到镭的电负性,可以取适量铅化镭和约3.5倍质量的铅混合在一起,共热至熔融后再冷却后即可)。此时镭226开始裂变为钌111。锑星科学家将此过程命名为“原料阶段” | |||
第二过程,钌111和铅208在锑场中核融合,形成[[钅岛|{{自造金属|岛}}]]319。注意到[[钅岛|{{自造金属|岛}}]]正好是第126号元素,位于稳定岛上,因此具有极高的稳定性。一般需要在此停留一段时间(约100秒),以确保镭226充分裂变,且钌111和铅208充分反应。 | |||
第三过程,将锑场强度减弱,至[[钅岛|{{自造金属|岛}}]]319开始衰变成[[钱]]319为止,它这时从第126号元素衰变到第120号元素,以极高的速度迅速完成6次β+衰变。锑星科学家将第二过程和第三过程合起来命名为“稳定岛跳板” | |||
第四过程,将锑场强度减弱,至Ubn319衰变成[[鿫]]319为止。[[鿫]]319恰好是碲球元素周期表的末尾。 | |||
第五过程,再度降低锑场强度,令[[鿫]]319迅速完成6次β+衰变,此时它会直接变成[[鿔]]319。研究表明,[[鿫]]319在衰变时也经过[[𫓧]]319,但由于[[𫓧]]319又迅速的β+衰变成鿔319,所以暂时不把这个单独列出来。可以把[[𫓧]]319视作衰变过程的一个小分支。 | |||
第六过程,将生成的鿔319冷却到100℃,再令其通过干冰冷却的Sb<sub>2</sub>Sb<sub>3</sub>表面,借助Sb<sub>2</sub>Sb<sub>3</sub>的较弱锑场完成最后一步核反应。受到Sb<sub>2</sub>Sb<sub>3</sub>对原子核的影响,鿔319再发生一次β+衰变,形成产物𬬭319。锑星科学家认为,由于中子数为奇数,而质子数为偶数,两者不匹配,所以鎶319会在弱锑场中发生β+衰变,使质子数变为偶数。至于为什么发生的不是β衰变,锑星科学家们百思不得其解。但相关实验表明,如果Sb2Sb3换成超盐酸酸化过的锑纳米管,它就会发生β衰变,生成[[鉨]]319。 | |||
[[File:制备𬬭.jpg|缩略图]] | |||
六个过程我们都已经介绍完毕。可用一张图来概括(“𫓧319”和“鉨319”的次要分支忽略不计) | |||
在实验室中,一份纯𬬭319的样本在放置了10年后,纯度下降到了原来的99.99%,计算可知𬬭319的半衰期为6928年(一说为6931年)。 | |||
== 𬬭化铵 == | == 𬬭化铵 == | ||
| 第39行: | 第78行: | ||
四𬬭化硅(相对分子质量:1304。以下称Rg<sub>4</sub>Si)是一种硅的𬬭化物。 | 四𬬭化硅(相对分子质量:1304。以下称Rg<sub>4</sub>Si)是一种硅的𬬭化物。 | ||
Rg<sub>4</sub>Si在真空下会缓慢地气化,同时伴随着分解,在1Pa以上加热Rg<sub>4</sub>Si只会使其分解而无法得到其蒸汽。Rg4Si易溶于四卤化碳、石油醚,接触水时非常缓慢地水解为原硅酸和𬬭化氢 | Rg<sub>4</sub>Si在真空下会缓慢地气化,同时伴随着分解,在1Pa以上加热Rg<sub>4</sub>Si只会使其分解而无法得到其蒸汽。Rg4Si易溶于四卤化碳、石油醚,接触水时非常缓慢地水解为原硅酸和𬬭化氢<ref name=":0" />(同时析出𬬭单质),接触氨时非常缓慢地氨解为氨基𬬭、氮化𬬭和硅烷(实际上还有氮化硅、硅单质、𬬭化铵)。 | ||
Rg<sub>4</sub>Si在发功时可以与镁反应生成Si(MgRg)<sub>4</sub>,这是一种罕见的硅𬬭镁试剂。 | Rg<sub>4</sub>Si在发功时可以与镁反应生成Si(MgRg)<sub>4</sub>,这是一种罕见的硅𬬭镁试剂。 | ||
== 四𬬭化二铋 == | == 四𬬭化二铋 == | ||
| 第54行: | 第87行: | ||
制备四𬬭化二铋是通过铋与三𬬭化铋隔绝空气加热。 | 制备四𬬭化二铋是通过铋与三𬬭化铋隔绝空气加热。 | ||
[[File:四𬬭化二铋.jpg|缩略图]] | [[File:四𬬭化二铋.jpg|缩略图]] | ||
在四𬬭化二铋的CCl<sub>4</sub>溶液中加入𬬭化氢 | 在四𬬭化二铋的CCl<sub>4</sub>溶液中加入𬬭化氢<ref name=":0" />并加热,一段时间后会析出六𬬭化十三铋Bi<sub>6</sub>Rg<sub>13</sub>,分子结构为变形八面体,六个铋(II)原子提供一个电子给中心𬬭原子。六𬬭化十三铋有一定氧化性,在水中逐渐分解为Bi<sub>2</sub>Rg<sub>4</sub>。 | ||
== [[鉨]]化𬬭 == | == [[鉨]]化𬬭 == | ||
| 第61行: | 第94行: | ||
鉨化𬬭与二𬬭化二[[鉲]]或二鉨化二鉲反应可生成三元准晶材料。 | 鉨化𬬭与二𬬭化二[[鉲]]或二鉨化二鉲反应可生成三元准晶材料。 | ||
反应方程式:①sqrt(5)-1RgNh+Ka2Rg2=(523.15K | 反应方程式:①sqrt(5)-1RgNh+Ka2Rg2=(523.15K,24h,10MPa;1273K,5.1day)=Nhsqrt(5)-1Rgsqrt(5)+1Ka | ||
②sqrt(5)-1RgNh+Ka2Nh<sub>2</sub>=(523.15K | ②sqrt(5)-1RgNh+Ka2Nh<sub>2</sub>=(523.15K,24h,10MPa;1273K,5.1day)=Nhsqrt(5)+1Rgsqrt(5)-1Ka | ||
反应方程式中的化学计量数并非有理数。 | 反应方程式中的化学计量数并非有理数。 | ||
| 第71行: | 第104行: | ||
以α-鉲/β-鉲为原料制取二𬬭化二鉲或二鉨化二鉲的一些流程: | 以α-鉲/β-鉲为原料制取二𬬭化二鉲或二鉨化二鉲的一些流程: | ||
将粉碎的鉲单质配成四氢呋喃悬浊液,然后向其中缓慢加入1%甲 | 将粉碎的鉲单质配成四氢呋喃悬浊液,然后向其中缓慢加入1%[[鉨]]甲烷乙醚溶液,然后通过蒸馏分离出Ka<sub>2</sub>(CH3)<sub>2</sub>,剩下的就是Ka<sub>2</sub>Nh<sub>2</sub>。将Ka<sub>2</sub>(CH<sub>3</sub>)<sub>2</sub>溶解在四氢呋喃中,向其中缓慢加入1%乙酰𬬭乙醚溶液,再通过蒸馏分离出Ka<sub>2</sub>Rg<sub>2</sub>。 | ||
== 乙酰𬬭 == | |||
乙酰𬬭的制取: | 乙酰𬬭的制取: | ||
CH<sub>3</sub>COBr+HRg=CH<sub>3</sub>CORg+HBr | CH<sub>3</sub>COBr+HRg=CH<sub>3</sub>CORg+HBr | ||
== 鉨鉲𬬭三元准晶 == | |||
Nhsqrt(5)+1Rgsqrt(5)-1Ka(下称富鉨的鉨鉲𬬭三元准晶)和Nhsqrt(5)-1Rgsqrt(5)+1Ka(下称富𬬭的鉨鉲錀三元准晶)被锑星科学家发现是两种准晶体,且具有比石墨烯更好的导电导热性能,导热系数是石墨烯的3.16倍(近似),电阻率是石墨烯的0.316倍(近似)。 | Nhsqrt(5)+1Rgsqrt(5)-1Ka(下称富鉨的鉨鉲𬬭三元准晶)和Nhsqrt(5)-1Rgsqrt(5)+1Ka(下称富𬬭的鉨鉲錀三元准晶)被锑星科学家发现是两种准晶体,且具有比石墨烯更好的导电导热性能,导热系数是石墨烯的3.16倍(近似),电阻率是石墨烯的0.316倍(近似)。 | ||
𬬭的惰性比金更高,因此它仅可 | == 𬬭(I) == | ||
𬬭的惰性比金更高,因此它仅可被F、[[钅炸|Bb]]以及一些特殊的高电负性元素氧化,而且即使被氧化,它也有很强烈的变回单质的倾向。以水为溶剂时,RgF易溶,RgCl微溶,Rg(NH<sub>3</sub>)<sub>2</sub>OH易溶,但它们在水中加热至350K后会析出𬬭单质。 | |||
怎样制备含𬬭(I)的化合物呢?我们可以使用非常强的配体,如氰根、硫硼。 | 怎样制备含𬬭(I)的化合物呢?我们可以使用非常强的配体,如氰根、硫硼。 | ||
| 第93行: | 第129行: | ||
由于氰中的碳采取的是sp杂化,其电负性升高,所以氰化𬬭RgCN中𬬭的化合价不好确定,这个问题锑星科学界争论至今。 | 由于氰中的碳采取的是sp杂化,其电负性升高,所以氰化𬬭RgCN中𬬭的化合价不好确定,这个问题锑星科学界争论至今。 | ||
氰化𬬭的水解机理是水电离出的OH-进攻 | 氰化𬬭的水解机理是水电离出的OH<sup>-</sup>进攻𬬭的7p1/2轨道,这个空轨道能量较低,于是形成RgOH和CN<sup>-</sup>,与H<sup>+</sup>结合生成HCN,这是在中性条件下。在酸性条件下,RgOH氧化性升高,将HCN氧化为HOCN的同时自身被还原为HRg<ref name=":0" />;在碱性条件下,HCN形成CN<sup>-</sup>,而RgOH以Rg(OH)<sub>2</sub><sup>-</sup>或RgO<sup>-</sup>的形式存在。 | ||
换了别的溶剂产物也会发生改变。以液氨为例,RgCN的氨解产物是Rg(NH<sub>3</sub>)<sub>2</sub>CN,真是神奇啊…… | 换了别的溶剂产物也会发生改变。以液氨为例,RgCN的氨解产物是Rg(NH<sub>3</sub>)<sub>2</sub>CN,真是神奇啊…… | ||
六𬬭化碳,化学式CRg<sub>6</sub>,是高烷CH<sub>6</sub>的全𬬭代物。它可以通过以下反应制取:CH<sub>6</sub>+6RgBF<sub>4</sub>—hν→CRg6+6HBF4。这个反应很难进行到最后一步,副产物经式三氢三𬬭高烷、面式三氢三 | == 六𬬭化碳 == | ||
六𬬭化碳,化学式CRg<sub>6</sub>,是高烷CH<sub>6</sub>的全𬬭代物。它可以通过以下反应制取:CH<sub>6</sub>+6RgBF<sub>4</sub>—hν→CRg6+6HBF4。这个反应很难进行到最后一步,副产物经式三氢三𬬭高烷、面式三氢三𬬭高烷、顺式二氢四𬬭高烷、反式二氢四𬬭高烷和五𬬭高烷也很多,所以六𬬭化碳的价格很昂贵。 | |||
加入AgF可以显著提高产率。 | 加入AgF可以显著提高产率。 | ||
| 第107行: | 第144行: | ||
五𬬭高烷易溶于常见的有机溶剂和水,溶液呈粉红色或金黄色(溶剂不同);而六𬬭化碳易溶于四卤化IV族元素和六卤化VI族元素,溶液呈棕黑色。两种物质都溶于超盐酸,且在其中为无色。 | 五𬬭高烷易溶于常见的有机溶剂和水,溶液呈粉红色或金黄色(溶剂不同);而六𬬭化碳易溶于四卤化IV族元素和六卤化VI族元素,溶液呈棕黑色。两种物质都溶于超盐酸,且在其中为无色。 | ||
五𬬭高烷有很强的酸性,能发生多种反应。例如:五𬬭高烷与汞反应生成Hg<sub>2</sub>(CRg<sub>5</sub>)<sub>2</sub>和Hg(CRg<sub>5</sub>)<sub>2</sub>;五𬬭高烷与水反应生成H<sub>9</sub>O<sub>4</sub>CRg<sub>5</sub>和H<sub>2</sub>O·2HCRg<sub>5</sub>;五𬬭高烷与羧酸/酰卤RCOOH/RCOX反应生成RCOCRg<sub>5</sub>,后续处理得到其他化合物。RCOCRg<sub>5</sub>在NbKa催化下加热分解为RCORg+CRg<sub>4</sub>,而在SbKa催化下加热分解为RCRg<sub>3</sub>+CORg<sub>2</sub>。{{元素周期表简表}}<references /> | 五𬬭高烷有很强的酸性,能发生多种反应。例如:五𬬭高烷与汞反应生成Hg<sub>2</sub>(CRg<sub>5</sub>)<sub>2</sub>和Hg(CRg<sub>5</sub>)<sub>2</sub>;五𬬭高烷与水反应生成H<sub>9</sub>O<sub>4</sub>CRg<sub>5</sub>和H<sub>2</sub>O·2HCRg<sub>5</sub>;五𬬭高烷与羧酸/酰卤RCOOH/RCOX反应生成RCOCRg<sub>5</sub>,后续处理得到其他化合物。RCOCRg<sub>5</sub>在NbKa催化下加热分解为RCORg+CRg<sub>4</sub>,而在SbKa催化下加热分解为RCRg<sub>3</sub>+CORg<sub>2</sub>。 | ||
== -3价𬬭 == | |||
𬬭有-3价,但简单的Rg(-III)不多。Na<sub>3</sub>Rg为例,它是NaRg在液态钠中反应24小时获得的。K<sub>3</sub>Rg和Cs<sub>3</sub>Rg可用类似的方法制取的。向𬬭化四甲基铵的三甲胺溶液中加入少量纯净的四甲基铵,会析出难溶的(NC<sub>4</sub>H<sub>12</sub>)3Rg,它的晶体结构类似Cs<sub>3</sub>Rg。𬬭化三季铵盐的烷基越大,盐越稳定。P、As、Bi的四烷基物不能和𬬭形成这样的化合物。 | |||
𬬭化三钠/钾/铯/钫都是银白色有蓝色至紫外色荧光的固体,熔点依次降低。𬬭化三季铵是此类物质中熔点最高的。他们普遍是离子化合物,按照制备工艺的不同其中还包含强度不同的魔键。 | |||
这些化合物遇水分解为氢氧化物和𬬭化三氢。H<sub>3</sub>Rg的酸性和碱性都非常弱,而且稳定性非常差,遇氮化氢/磷化氢分解为NH<sub>4</sub>Rg/PH<sub>4</sub>Rg,遇氟化氢/氰化氢分解为RgF/RgCN(而HRg<ref name=":0" />与HF/HCN混合只生成络合物),分解速率取决于溶剂酸性或碱性。 | |||
== 二氦合高溴酸𬬭 == | |||
二氦合高溴酸𬬭,化学式(RgHe<sub>2</sub>)BrO<sub>4</sub>,是一种含有稀有气体化合物的离子化合物,阳离子为RgHe<sub>2</sub><sup>+</sup>。高溴酸𬬭的晶体暴露在120MPa以上高压氦气气流中就会少量生成这种物质,要用锑鉲合金材质的容器在氦气氛围中低温储存。 | |||
理论上,只要是含Rg<sup>+</sup>的离子化合物都可以合成上述物质。除去一些含氟阴离子,目前已经尝试过RgClO<sub>4</sub>、RgIO<sub>4</sub>、RgMnO<sub>4</sub>、RgAmO<sub>4</sub>(不稳定)、RgAtO<sub>4</sub>(不稳定)、RgYrO<sub>4</sub>(不稳定)、Rg<sub>2</sub>MnO<sub>4</sub>(不稳定)、Rg<sub>2</sub>FeO<sub>4</sub>、Rg<sub>2</sub>NiO<sub>4</sub>(不稳定)、Rg<sub>2</sub>SeO<sub>4</sub>、Rg<sub>2</sub>TeO<sub>4</sub>、Rg<sub>2</sub>RhO<sub>4</sub>、Rg<sub>2</sub>PdO<sub>4</sub>(不稳定)、Rg<sub>2</sub>IrO<sub>4</sub>、Rg<sub>2</sub>PtO<sub>4</sub>(不稳定)、RgPoO<sub>4</sub>、Rg<sub>2</sub>PuO<sub>5</sub>(不稳定)、Rg<sub>2</sub>AmO<sub>4</sub>、Rg<sub>2</sub>CmO<sub>4</sub>(不稳定)、Rg<sub>2</sub>MeO<sub>4</sub>(不稳定),效果都比较理想。有些化合物稳定性不好,温度一高就会产生Rg<sub>4</sub>O<sub>6</sub>和RgO<sup>+</sup>。 | |||
RgHe<sub>2</sub><sup>+</sup>离子为直线型,氦原子充当2电子配体,给Rg+的7s-6d轨道和7p1/2填充电子。由于RgHe<sup>+</sup>里氦原子只填充了Rg<sup>+</sup>的7s-6d轨道,也是一个能量比较低的稳定结构,故存在下列平衡:RgHe<sub>2</sub><sup>+</sup>⇌RgHe<sup>+</sup>+He,加热促进反应。 | |||
RgHe<sub>2</sub><sup>+</sup>会和一氧化碳反应,而产物非常复杂,这其中的细节锑星科学家还没有搞清楚。 | |||
== KRg(CN)<sub>2</sub> == | |||
Rg可以溶解在KCN+H<sub>2</sub>O<sub>2</sub>溶液中,可生成KRg(CN)<sub>2</sub>,另外还有KRg(CN)<sub>2</sub>溶液呈中性,且是淡黝红色透明,因为KRg(CN)<sub>2</sub>是强酸强碱盐。 | |||
在水里,KRg(CN)<sub>2</sub>和氯气反应生成各种化合物,没什么好说的。KRg(CN)<sub>2</sub>和CNF生成Rg(CN)<sub>3</sub>。这个物质稳定性都很差,0℃时就会分解出(CN)<sub>2</sub>,配成溶液则能稳定存在。 | |||
与金不同,KRg(CN)<sub>2</sub>是无毒的。{{元素周期表简表}}<references /> | |||
[[Category:元素]] | |||
[[Category:金属]] | |||
[[Category:超理化学]] | |||
於 2023年6月2日 (五) 11:50 的最新修訂
錀,111號元素,符號Rg。
在銻星已經大量製得其相對穩定的同位素錀-319,而碲球製備出的錀-282半衰期僅1分鐘。
錀是一種電負性很高的金屬(但沒有鉨和鿬高),某不可靠資料稱其電負性約為3.0(其實只有1.51)。[1]
錀是一種貴金屬,可以製作首飾和獎牌。
目前銻星科學家觀察到以下現象:
1.錀單質在加熱的狀態下能吸收氫氣
2.錀的配合物或錀的磷酸二氫鹽在稀磷酸中被稍過量的氫前金屬還原時會生成錀的氫化物[2]
3.錀的氫化物在某些非極性溶劑中可以溶解,並電離出氫離子
4.錀的氫化物可以和氨水或通入溶劑中的氨氣反應,形成沉澱。其顏色從灰黑色到銀白色隨機分佈。
錀預計主要形成穩定的+3和+5態。錀的惰性比金更高,Rg3+/Rg對的標準電極電勢1.9V大於Au3+/Au對的1.5V,將不會與氧和鹵素(氟除外)發生反應。
6d軌道因第四過渡金屬系列末端附近的相對論效應和自旋-軌道相互作用而不穩定,因此使高氧化態錀(V)比其較輕的同系物金(V)更穩定,因為6d電子在更大程度上參與成鍵。
錀一般最高有+5價,而且是以共價化合物的形式存在。能以離子形式存在的最高價態為+3,以六氟合金酸鹽、六氟合銻酸鹽、六氟合鉍酸鹽的形式存在。
但用臭氟氧化三氟化錀可以得到RgF5·F2的加合物。由於五氟化錀是比五氟化金更強的路易斯酸,HRgF6擁有遠強於HAuF6的變態酸性,並且可以穩定存在(不像HAuF6會分解放出氟氣)。
RgF5和NaRgF6是銻星常用的強氧化劑,均可溶於水。在配製RgF5溶液時需要加鹼,否則會迅速氧化水,NaRgF6則不用,這兩個溶液都不能長時間放置,因為還是會緩慢氧化水(類似於高鐵酸鉀)。
另外,用臭氟氧化三氧化二錀生成O3RgF6,其中含有臭氧正離子(三中心三電子π鍵)。它很不穩定,容易迅速轉化為O3(RgF6)2,此時臭氧分子兩段都帶正電荷。
製備[編輯]
錀319核素的原子核中包含了208個中子,正好對應它的原料之一:鉛208;而111個質子對應它的另一種原料:釕111。
鉛208,眾所周知,是個穩定的核素。可是釕111呢?穩定的釕同位素中,最重的也不過是釕104,要靠中子輻照的方法把它堆到釕111的話,它在那之前早就通過β衰變成鎘111了。
所以,我們只能依靠重元素的核裂變。銻星科學家研究發現,將鐳226置於極強銻場中,它會自發的核裂變,生成釕111,和4個中子。
在搞定了原料之一——釕111的合成後,我們就可以開始考慮完整的核反應過程了。
第一過程,將含鉛量大於84.667%的鉛208鐳226合金放在強銻場中(考慮到鐳的電負性,可以取適量鉛化鐳和約3.5倍質量的鉛混合在一起,共熱至熔融後再冷卻後即可)。此時鐳226開始裂變為釕111。銻星科學家將此過程命名為「原料階段」
第二過程,釕111和鉛208在銻場中核融合,形成319。注意到正好是第126號元素,位於穩定島上,因此具有極高的穩定性。一般需要在此停留一段時間(約100秒),以確保鐳226充分裂變,且釕111和鉛208充分反應。
第三過程,將銻場強度減弱,至319開始衰變成錢319為止,它這時從第126號元素衰變到第120號元素,以極高的速度迅速完成6次β+衰變。銻星科學家將第二過程和第三過程合起來命名為「穩定島跳板」
第四過程,將銻場強度減弱,至Ubn319衰變成鿫319為止。鿫319恰好是碲球元素周期表的末尾。
第五過程,再度降低銻場強度,令鿫319迅速完成6次β+衰變,此時它會直接變成鎶319。研究表明,鿫319在衰變時也經過鈇319,但由於鈇319又迅速的β+衰變成鎶319,所以暫時不把這個單獨列出來。可以把鈇319視作衰變過程的一個小分支。
第六過程,將生成的鎶319冷卻到100℃,再令其通過乾冰冷卻的Sb2Sb3表面,藉助Sb2Sb3的較弱銻場完成最後一步核反應。受到Sb2Sb3對原子核的影響,鎶319再發生一次β+衰變,形成產物錀319。銻星科學家認為,由於中子數為奇數,而質子數為偶數,兩者不匹配,所以鎶319會在弱銻場中發生β+衰變,使質子數變為偶數。至於為什麼發生的不是β衰變,銻星科學家們百思不得其解。但相關實驗表明,如果Sb2Sb3換成超鹽酸酸化過的銻納米管,它就會發生β衰變,生成鉨319。

六個過程我們都已經介紹完畢。可用一張圖來概括(「鈇319」和「鉨319」的次要分支忽略不計)
在實驗室中,一份純錀319的樣本在放置了10年後,純度下降到了原來的99.99%,計算可知錀319的半衰期為6928年(一說為6931年)。
錀化銨[編輯]
目前,銻星科學家仍在爭論錀化銨到底是離子化合物還是合金。
wiki上的數據表明,銨根離子的半徑為133pm,而錀原子的共價半徑僅有121pm。即使考慮到額外的負電荷使錀原子半徑增大,錀離子的半徑也大不到哪裏去。
錀化銨為體心立方晶胞,晶胞中心的銨根為正四面體,氫原子既與氮原子形成共價鍵,又與錀原子形成氫鍵。
錀化銨對熱穩定,加熱至56℃左右即融化,但熱至800℃分解。它僅溶於汞,且緩慢分解。
一般所謂的錀化銨指的都是錀化四氕銨,而實際上錀化四氕銨有非常特殊的性質,那就是可以從含氘化合物中富集氘。
有此反應:NH4Rg+4HDO⇌ND4Rg+4H2O。此反應在常溫下完全進行到底,錀化四氕銨最終完全轉化為錀化四氘銨。目前尚無法觀測到中間產物。
錀化四氘銨,簡稱錀化氘銨,熔點為80℃。其熱穩定性高於錀化氕銨,熱至1000℃仍不分解。導熱性這一塊,錀化氘銨也強過錀化氕銨。
錀化氘銨的密度大於錀化氕銨,且錀化氘銨的晶胞的邊長比錀化氕銨的小,因為氘原子與錀原子形成的氫鍵強度更大,原子間距離更小一些。
錀化氕銨和錀化氘銨都能結成完美的立方體結晶,而且呈金屬光澤。
四錀化硅[編輯]
四錀化硅(相對分子質量:1304。以下稱Rg4Si)是一種硅的錀化物。
Rg4Si在真空下會緩慢地氣化,同時伴隨着分解,在1Pa以上加熱Rg4Si只會使其分解而無法得到其蒸汽。Rg4Si易溶於四鹵化碳、石油醚,接觸水時非常緩慢地水解為原硅酸和錀化氫[2](同時析出錀單質),接觸氨時非常緩慢地氨解為氨基錀、氮化錀和硅烷(實際上還有氮化硅、硅單質、錀化銨)。
Rg4Si在發功時可以與鎂反應生成Si(MgRg)4,這是一種罕見的硅錀鎂試劑。
四錀化二鉍[編輯]
四錀化二鉍Bi2Rg4。它是已知最穩定的鉍(II)化合物,加熱到170℃歧化為BiRg3、BiRg和Bi。
製備四錀化二鉍是通過鉍與三錀化鉍隔絕空氣加熱。
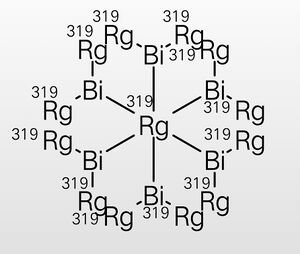
在四錀化二鉍的CCl4溶液中加入錀化氫[2]並加熱,一段時間後會析出六錀化十三鉍Bi6Rg13,分子結構為變形八面體,六個鉍(II)原子提供一個電子給中心錀原子。六錀化十三鉍有一定氧化性,在水中逐漸分解為Bi2Rg4。
鉨化錀[編輯]
錀(I)離子和鉨(-I)離子接觸時會形成鉨化錀沉澱,其化學式為RgNh。
鉨化錀與二錀化二鉲或二鉨化二鉲反應可生成三元准晶材料。
反應方程式:①sqrt(5)-1RgNh+Ka2Rg2=(523.15K,24h,10MPa;1273K,5.1day)=Nhsqrt(5)-1Rgsqrt(5)+1Ka
②sqrt(5)-1RgNh+Ka2Nh2=(523.15K,24h,10MPa;1273K,5.1day)=Nhsqrt(5)+1Rgsqrt(5)-1Ka
反應方程式中的化學計量數並非有理數。
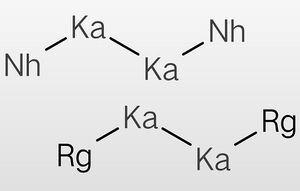
二錀化二鉲、二鉨化二鉲都是分子晶體,常溫為液體,高溫下易發生歧化反應。在使用這兩種物質合成Nhsqrt(5)-1Rgsqrt(5)+1Ka和Nhsqrt(5)+1Rgsqrt(5)-1Ka時,需要先將反應物的混合物在250℃的高壓氛圍中加熱一段時間,然後再送至1000℃的環境中灼燒。
以α-鉲/β-鉲為原料製取二錀化二鉲或二鉨化二鉲的一些流程:
將粉碎的鉲單質配成四氫呋喃懸濁液,然後向其中緩慢加入1%鉨甲烷乙醚溶液,然後通過蒸餾分離出Ka2(CH3)2,剩下的就是Ka2Nh2。將Ka2(CH3)2溶解在四氫呋喃中,向其中緩慢加入1%乙酰錀乙醚溶液,再通過蒸餾分離出Ka2Rg2。
乙酰錀[編輯]
乙酰錀的製取:
CH3COBr+HRg=CH3CORg+HBr
鉨鉲錀三元准晶[編輯]
Nhsqrt(5)+1Rgsqrt(5)-1Ka(下稱富鉨的鉨鉲錀三元准晶)和Nhsqrt(5)-1Rgsqrt(5)+1Ka(下稱富錀的鉨鉲錀三元准晶)被銻星科學家發現是兩種准晶體,且具有比石墨烯更好的導電導熱性能,導熱係數是石墨烯的3.16倍(近似),電阻率是石墨烯的0.316倍(近似)。
錀(I)[編輯]
錀的惰性比金更高,因此它僅可被F、Bb以及一些特殊的高電負性元素氧化,而且即使被氧化,它也有很強烈的變回單質的傾向。以水為溶劑時,RgF易溶,RgCl微溶,Rg(NH3)2OH易溶,但它們在水中加熱至350K後會析出錀單質。
怎樣製備含錀(I)的化合物呢?我們可以使用非常強的配體,如氰根、硫硼。
以氰根為配體的有Rg(CN)2和Rg(CN)4陽離子,其製取方法:BrRg+(CN)2=二乙基甲氧烷,37℃=Rg(CN)2Br。
Rg(CN)4陽離子很難製備,一般通過異氰化鉲催化(CN)2與Rg(CN)2陽離子反應製取。這個反應是放熱反應,活化能非常高,反應平衡常數極大(>1051)。Rg(CN)4陽離子的穩定性更高,而且可與硫離子結合,生成[Rg(CN)4]2S,而Rg(CN)2陽離子與硫離子結合時生成[Rg(CN)2]SCN。
而以硫硼為配體時,有Rg(SB)4和Rg(SB)8陽離子。Rg(SB)4陽離子的穩定性極高,而Rg(SB)8陽離子的穩定性較差。
室溫下,用中波紫外線照射Rg(SB)8陽離子就會使它分解出S4B4,這個分子本身是八元環結構,但與錀(I)離子絡合後摺疊為立方體形,[Rg(S4B4)]Br穩定性比[Rg(SB)4]Br更好,但[Rg(SB)4]Br不能直接轉化為[Rg(S4B4)]Br。
由於氰中的碳採取的是sp雜化,其電負性升高,所以氰化錀RgCN中錀的化合價不好確定,這個問題銻星科學界爭論至今。
氰化錀的水解機理是水電離出的OH-進攻錀的7p1/2軌道,這個空軌道能量較低,於是形成RgOH和CN-,與H+結合生成HCN,這是在中性條件下。在酸性條件下,RgOH氧化性升高,將HCN氧化為HOCN的同時自身被還原為HRg[2];在鹼性條件下,HCN形成CN-,而RgOH以Rg(OH)2-或RgO-的形式存在。
換了別的溶劑產物也會發生改變。以液氨為例,RgCN的氨解產物是Rg(NH3)2CN,真是神奇啊……
六錀化碳[編輯]
六錀化碳,化學式CRg6,是高烷CH6的全錀代物。它可以通過以下反應製取:CH6+6RgBF4—hν→CRg6+6HBF4。這個反應很難進行到最後一步,副產物經式三氫三錀高烷、面式三氫三錀高烷、順式二氫四錀高烷、反式二氫四錀高烷和五錀高烷也很多,所以六錀化碳的價格很昂貴。
加入AgF可以顯著提高產率。
一般錀原子數越大的高烷衍生物熔點越高,而五錀高烷和六錀化碳的熔點反常地降低了。
五錀高烷熔點不明,六錀化碳的熔點為349.23℃。這些化合物在常壓下加熱到450℃時開始分解,600℃時幾乎分解完畢,但在低壓下它們存在氣態。
五錀高烷易溶於常見的有機溶劑和水,溶液呈粉紅色或金黃色(溶劑不同);而六錀化碳易溶於四鹵化IV族元素和六鹵化VI族元素,溶液呈棕黑色。兩種物質都溶於超鹽酸,且在其中為無色。
五錀高烷有很強的酸性,能發生多種反應。例如:五錀高烷與汞反應生成Hg2(CRg5)2和Hg(CRg5)2;五錀高烷與水反應生成H9O4CRg5和H2O·2HCRg5;五錀高烷與羧酸/酰鹵RCOOH/RCOX反應生成RCOCRg5,後續處理得到其他化合物。RCOCRg5在NbKa催化下加熱分解為RCORg+CRg4,而在SbKa催化下加熱分解為RCRg3+CORg2。
-3價錀[編輯]
錀有-3價,但簡單的Rg(-III)不多。Na3Rg為例,它是NaRg在液態鈉中反應24小時獲得的。K3Rg和Cs3Rg可用類似的方法製取的。向錀化四甲基銨的三甲胺溶液中加入少量純淨的四甲基銨,會析出難溶的(NC4H12)3Rg,它的晶體結構類似Cs3Rg。錀化三季銨鹽的烷基越大,鹽越穩定。P、As、Bi的四烷基物不能和錀形成這樣的化合物。
錀化三鈉/鉀/銫/鈁都是銀白色有藍色至紫外色熒光的固體,熔點依次降低。錀化三季銨是此類物質中熔點最高的。他們普遍是離子化合物,按照製備工藝的不同其中還包含強度不同的魔鍵。
這些化合物遇水分解為氫氧化物和錀化三氫。H3Rg的酸性和鹼性都非常弱,而且穩定性非常差,遇氮化氫/磷化氫分解為NH4Rg/PH4Rg,遇氟化氫/氰化氫分解為RgF/RgCN(而HRg[2]與HF/HCN混合只生成絡合物),分解速率取決於溶劑酸性或鹼性。
二氦合高溴酸錀[編輯]
二氦合高溴酸錀,化學式(RgHe2)BrO4,是一種含有稀有氣體化合物的離子化合物,陽離子為RgHe2+。高溴酸錀的晶體暴露在120MPa以上高壓氦氣氣流中就會少量生成這種物質,要用銻鉲合金材質的容器在氦氣氛圍中低溫儲存。
理論上,只要是含Rg+的離子化合物都可以合成上述物質。除去一些含氟陰離子,目前已經嘗試過RgClO4、RgIO4、RgMnO4、RgAmO4(不穩定)、RgAtO4(不穩定)、RgYrO4(不穩定)、Rg2MnO4(不穩定)、Rg2FeO4、Rg2NiO4(不穩定)、Rg2SeO4、Rg2TeO4、Rg2RhO4、Rg2PdO4(不穩定)、Rg2IrO4、Rg2PtO4(不穩定)、RgPoO4、Rg2PuO5(不穩定)、Rg2AmO4、Rg2CmO4(不穩定)、Rg2MeO4(不穩定),效果都比較理想。有些化合物穩定性不好,溫度一高就會產生Rg4O6和RgO+。
RgHe2+離子為直線型,氦原子充當2電子配體,給Rg+的7s-6d軌道和7p1/2填充電子。由於RgHe+里氦原子只填充了Rg+的7s-6d軌道,也是一個能量比較低的穩定結構,故存在下列平衡:RgHe2+⇌RgHe++He,加熱促進反應。
RgHe2+會和一氧化碳反應,而產物非常複雜,這其中的細節銻星科學家還沒有搞清楚。
KRg(CN)2[編輯]
Rg可以溶解在KCN+H2O2溶液中,可生成KRg(CN)2,另外還有KRg(CN)2溶液呈中性,且是淡黝紅色透明,因為KRg(CN)2是強酸強鹼鹽。
在水裏,KRg(CN)2和氯氣反應生成各種化合物,沒什麼好說的。KRg(CN)2和CNF生成Rg(CN)3。這個物質穩定性都很差,0℃時就會分解出(CN)2,配成溶液則能穩定存在。
與金不同,KRg(CN)2是無毒的。
| 元素周期表 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
<tabber>複數周期=
|