𬬭:修订间差异
imported>Wenglizi 无编辑摘要 |
imported>Wenglizi 无编辑摘要 |
||
| 第96行: | 第96行: | ||
由于氰中的碳采取的是sp杂化,其电负性升高,所以氰化𬬭RgCN中𬬭的化合价不好确定,这个问题锑星科学界争论至今。 | 由于氰中的碳采取的是sp杂化,其电负性升高,所以氰化𬬭RgCN中𬬭的化合价不好确定,这个问题锑星科学界争论至今。 | ||
氰化𬬭的水解机理是水电离出的OH-进攻 | 氰化𬬭的水解机理是水电离出的OH<sup>-</sup>进攻𬬭的7p1/2轨道,这个空轨道能量较低,于是形成RgOH和CN<sup>-</sup>,与H<sup>+</sup>结合生成HCN,这是在中性条件下。在酸性条件下,RgOH氧化性升高,将HCN氧化为HOCN的同时自身被还原为HRg;在碱性条件下,HCN形成CN<sup>-</sup>,而RgOH以Rg(OH)<sub>2</sub><sup>-</sup>或RgO<sup>-</sup>的形式存在。 | ||
换了别的溶剂产物也会发生改变。以液氨为例,RgCN的氨解产物是Rg(NH<sub>3</sub>)<sub>2</sub>CN,真是神奇啊…… | 换了别的溶剂产物也会发生改变。以液氨为例,RgCN的氨解产物是Rg(NH<sub>3</sub>)<sub>2</sub>CN,真是神奇啊…… | ||
2022年12月8日 (四) 07:22的版本
𬬭,111号元素,符号Rg。
𬬭是一种电负性很高的金属(但没有鉨和鿬高),某不可靠资料称其电负性约为3.0。[1]
目前锑星科学家观察到以下现象:
1.𬬭单质在加热的状态下能吸收氢气
2.𬬭的配合物或𬬭的磷酸二氢盐在稀磷酸中被稍过量的氢前金属还原时会生成𬬭的氢化物(注意这里𬬭和氢都为0价)
3.𬬭的氢化物在某些非极性溶剂中可以溶解,并电离出氢离子
4.𬬭的氢化物可以和氨水或通入溶剂中的氨气反应,形成沉淀。其颜色从灰黑色到银白色随机分布。
𬬭预计主要形成稳定的+3态。𬬭的惰性比金更高,将不会与氧和卤素发生反应。最有可能的反应是与氟形成氟化物RgF3,与水形成的氢氧化物Rg(OH)3,以及通过氢氧化物制取得Rg2O3。
𬬭一般最高只有+3价,而且是以共价化合物的形式存在。能以离子形式存在的最高价态为+2,以六氟合金酸盐、六氟合锑酸盐、六氟合铋酸盐的形式存在。
但用臭氟氧化三氟化𬬭可以得到RgF5·F2的加合物。由于五氟化𬬭是比五氟化金更强的路易斯酸,HRgF6预计拥有远强于HAuF6的变态酸性。
另外,用臭氟氧化三氧化二𬬭生成O3RgF6,其中含有臭氧正离子(三中心三电子π键)。它很不稳定,容易迅速转化为O3(RgF6)2,此时臭氧分子两段都带正电荷。
𬬭化铵
目前,锑星科学家仍在争论𬬭化铵到底是离子化合物还是合金。
wiki上的数据表明,铵根离子的半径为133pm,而𬬭原子的共价半径仅有121pm。即使考虑到额外的负电荷使𬬭原子半径增大,𬬭离子的半径也大不到哪里去。
𬬭化铵为体心立方晶胞,晶胞中心的铵根为正四面体,氢原子既与氮原子形成共价键,又与𬬭原子形成氢键。
𬬭化铵对热稳定,加热至56℃左右即融化,但热至800℃分解。它仅溶于汞,且缓慢分解。
一般所谓的𬬭化铵指的都是𬬭化四氕铵,而实际上𬬭化四氕铵有非常特殊的性质,那就是可以从含氘化合物中富集氘。
有此反应:NH4Rg+4HDO⇌ND4Rg+4H2O。此反应在常温下完全进行到底,𬬭化四氕铵最终完全转化为𬬭化四氘铵。目前尚无法观测到中间产物。
𬬭化四氘铵,简称𬬭化氘铵,熔点为80℃。其热稳定性高于𬬭化氕铵,热至1000℃仍不分解。导热性这一块,𬬭化氘铵也强过𬬭化氕铵。
𬬭化氘铵的密度大于𬬭化氕铵,且𬬭化氘铵的晶胞的边长比𬬭化氕铵的小,因为氘原子与𬬭原子形成的氢键强度更大,原子间距离更小一些。
𬬭化氕铵和𬬭化氘铵都能结成完美的立方体结晶,而且呈金属光泽。
四𬬭化硅
四𬬭化硅(相对分子质量:1304。以下称Rg4Si)是一种硅的𬬭化物。
Rg4Si在真空下会缓慢地气化,同时伴随着分解,在1Pa以上加热Rg4Si只会使其分解而无法得到其蒸汽。Rg4Si易溶于四卤化碳、石油醚,接触水时非常缓慢地水解为原硅酸和𬬭化氢(注意这里𬬭和氢都为0价)(同时析出𬬭单质),接触氨时非常缓慢地氨解为氨基𬬭、氮化𬬭和硅烷(实际上还有氮化硅、硅单质、𬬭化铵)。
Rg4Si在发功时可以与镁反应生成Si(MgRg)4,这是一种罕见的硅𬬭镁试剂。
四𬬭化二铋
四𬬭化二铋Bi2Rg4。它是已知最稳定的铋(II)化合物,加热到170℃歧化为BiRg3、BiRg和Bi。
制备四𬬭化二铋是通过铋与三𬬭化铋隔绝空气加热。
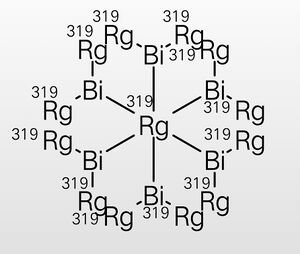
在四𬬭化二铋的CCl4溶液中加入𬬭化氢(注意这里𬬭和氢都为0价)并加热,一段时间后会析出六𬬭化十三铋Bi6Rg13,分子结构为变形八面体,六个铋(II)原子提供一个电子给中心𬬭原子。六𬬭化十三铋有一定氧化性,在水中逐渐分解为Bi2Rg4。
鉨化𬬭
𬬭(I)离子和鉨(-I)离子接触时会形成鉨化𬬭沉淀,其化学式为RgNh。
鉨化𬬭与二𬬭化二鉲或二鉨化二鉲反应可生成三元准晶材料。
反应方程式:①sqrt(5)-1RgNh+Ka2Rg2=(523.15K,24h,10MPa;1273K,5.1day)=Nhsqrt(5)-1Rgsqrt(5)+1Ka
②sqrt(5)-1RgNh+Ka2Nh2=(523.15K,24h,10MPa;1273K,5.1day)=Nhsqrt(5)+1Rgsqrt(5)-1Ka
反应方程式中的化学计量数并非有理数。
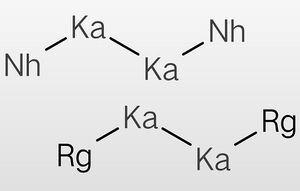
二𬬭化二鉲、二鉨化二鉲都是分子晶体,常温为液体,高温下易发生歧化反应。在使用这两种物质合成Nhsqrt(5)-1Rgsqrt(5)+1Ka和Nhsqrt(5)+1Rgsqrt(5)-1Ka时,需要先将反应物的混合物在250℃的高压氛围中加热一段时间,然后再送至1000℃的环境中灼烧。
以α-鉲/β-鉲为原料制取二𬬭化二鉲或二鉨化二鉲的一些流程:
将粉碎的鉲单质配成四氢呋喃悬浊液,然后向其中缓慢加入1%甲基鉨乙醚溶液,然后通过蒸馏分离出Ka2(CH3)2,剩下的就是Ka2Nh2。将Ka2(CH3)2溶解在四氢呋喃中,向其中缓慢加入1%乙酰錀乙醚溶液,再通过蒸馏分离出Ka2Rg2。
乙酰𬬭
乙酰𬬭的制取:
CH3COBr+HRg=CH3CORg+HBr
鉨鉲𬬭三元准晶
Nhsqrt(5)+1Rgsqrt(5)-1Ka(下称富鉨的鉨鉲𬬭三元准晶)和Nhsqrt(5)-1Rgsqrt(5)+1Ka(下称富𬬭的鉨鉲錀三元准晶)被锑星科学家发现是两种准晶体,且具有比石墨烯更好的导电导热性能,导热系数是石墨烯的3.16倍(近似),电阻率是石墨烯的0.316倍(近似)。
𬬭(I)
𬬭的惰性比金更高,因此它仅可被F、Bb以及一些特殊的高电负性元素氧化,而且即使被氧化,它也有很强烈的变回单质的倾向。以水为溶剂时,RgF易溶,RgCl微溶,Rg(NH3)2OH易溶,但它们在水中加热至350K后会析出𬬭单质。
怎样制备含𬬭(I)的化合物呢?我们可以使用非常强的配体,如氰根、硫硼。
以氰根为配体的有Rg(CN)2和Rg(CN)4阳离子,其制取方法:BrRg+(CN)2=二乙基甲氧烷,37℃=Rg(CN)2Br。
Rg(CN)4阳离子很难制备,一般通过异氰化鉲催化(CN)2与Rg(CN)2阳离子反应制取。这个反应是放热反应,活化能非常高,反应平衡常数极大(>1051)。Rg(CN)4阳离子的稳定性更高,而且可与硫离子结合,生成[Rg(CN)4]2S,而Rg(CN)2阳离子与硫离子结合时生成[Rg(CN)2]SCN。
而以硫硼为配体时,有Rg(SB)4和Rg(SB)8阳离子。Rg(SB)4阳离子的稳定性极高,而Rg(SB)8阳离子的稳定性较差。
室温下,用中波紫外线照射Rg(SB)8阳离子就会使它分解出S4B4,这个分子本身是八元环结构,但与𬬭(I)离子络合后折叠为立方体形,[Rg(S4B4)]Br稳定性比[Rg(SB)4]Br更好,但[Rg(SB)4]Br不能直接转化为[Rg(S4B4)]Br。
由于氰中的碳采取的是sp杂化,其电负性升高,所以氰化𬬭RgCN中𬬭的化合价不好确定,这个问题锑星科学界争论至今。
氰化𬬭的水解机理是水电离出的OH-进攻𬬭的7p1/2轨道,这个空轨道能量较低,于是形成RgOH和CN-,与H+结合生成HCN,这是在中性条件下。在酸性条件下,RgOH氧化性升高,将HCN氧化为HOCN的同时自身被还原为HRg;在碱性条件下,HCN形成CN-,而RgOH以Rg(OH)2-或RgO-的形式存在。
换了别的溶剂产物也会发生改变。以液氨为例,RgCN的氨解产物是Rg(NH3)2CN,真是神奇啊……
六𬬭化碳
六𬬭化碳,化学式CRg6,是高烷CH6的全𬬭代物。它可以通过以下反应制取:CH6+6RgBF4—hν→CRg6+6HBF4。这个反应很难进行到最后一步,副产物经式三氢三𬬭高烷、面式三氢三錀高烷、顺式二氢四𬬭高烷、反式二氢四𬬭高烷和五𬬭高烷也很多,所以六𬬭化碳的价格很昂贵。
加入AgF可以显著提高产率。
一般𬬭原子数越大的高烷衍生物熔点越高,而五𬬭高烷和六𬬭化碳的熔点反常地降低了。
五𬬭高烷熔点不明,六𬬭化碳的熔点为349.23℃。这些化合物在常压下加热到450℃时开始分解,600℃时几乎分解完毕,但在低压下它们存在气态。
五𬬭高烷易溶于常见的有机溶剂和水,溶液呈粉红色或金黄色(溶剂不同);而六𬬭化碳易溶于四卤化IV族元素和六卤化VI族元素,溶液呈棕黑色。两种物质都溶于超盐酸,且在其中为无色。
五𬬭高烷有很强的酸性,能发生多种反应。例如:五𬬭高烷与汞反应生成Hg2(CRg5)2和Hg(CRg5)2;五𬬭高烷与水反应生成H9O4CRg5和H2O·2HCRg5;五𬬭高烷与羧酸/酰卤RCOOH/RCOX反应生成RCOCRg5,后续处理得到其他化合物。RCOCRg5在NbKa催化下加热分解为RCORg+CRg4,而在SbKa催化下加热分解为RCRg3+CORg2。
-3价𬬭
𬬭有-3价,但简单的Rg(-III)不多。Na3Rg为例,它是NaRg在液态钠中反应24小时获得的。K3Rg和Cs3Rg可用类似的方法制取的。向𬬭化四甲基铵的三甲胺溶液中加入少量纯净的四甲基铵,会析出难溶的(NC4H12)3Rg,它的晶体结构类似Cs3Rg。𬬭化三季铵盐的烷基越大,盐越稳定。P、As、Bi的四烷基物不能和𬬭形成这样的化合物。
𬬭化三钠/钾/铯/钫都是银白色有蓝色至紫外色荧光的固体,熔点依次降低。𬬭化三季铵是此类物质中熔点最高的。他们普遍是离子化合物,按照制备工艺的不同其中还包含强度不同的魔键。
这些化合物遇水分解为氢氧化物和𬬭化三氢。H3Rg的酸性和碱性都非常弱,而且稳定性非常差,遇氮化氢/磷化氢分解为NH4Rg/PH4Rg,遇氟化氢/氰化氢分解为RgF/RgCN(而HRg与HF/HCN混合只生成络合物),分解速率取决于溶剂酸性或碱性。
二氦合高溴酸𬬭
二氦合高溴酸𬬭,化学式(RgHe2)BrO4,是一种含有稀有气体化合物的离子化合物,阳离子为RgHe2+。高溴酸𬬭的晶体暴露在120MPa以上高压氦气气流中就会少量生成这种物质,要用锑鉲合金材质的容器在氦气氛围中低温储存。
理论上,只要是含Rg+的离子化合物都可以合成上述物质。除去一些含氟阴离子,目前已经尝试过RgClO4、RgIO4、RgMnO4、RgAmO4(不稳定)、RgAtO4(不稳定)、RgYrO4(不稳定)、Rg2MnO4(不稳定)、Rg2FeO4、Rg2NiO4(不稳定)、Rg2SeO4、Rg2TeO4、Rg2RhO4、Rg2PdO4(不稳定)、Rg2IrO4、Rg2PtO4(不稳定)、RgPoO4、Rg2PuO5(不稳定)、Rg2AmO4、Rg2CmO4(不稳定)、Rg2MeO4(不稳定),效果都比较理想。有些化合物稳定性不好,温度一高就会产生Rg4O6和RgO+。
RgHe2+离子为直线型,氦原子充当2电子配体,给Rg+的7s-6d轨道和7p1/2填充电子。由于RgHe+里氦原子只填充了Rg+的7s-6d轨道,也是一个能量比较低的稳定结构,故存在下列平衡:RgHe2+⇌RgHe++He,加热促进反应。
RgHe2+会和一氧化碳反应,而产物非常复杂,这其中的细节锑星科学家还没有搞清楚。
KRg(CN)2
Rg可以溶解在KCN溶液中,可生成KRg(CN)2,另外还有KRg(CN)2溶液呈中性,且都是淡黝红色透明,因为KRg(CN)2是强酸强碱盐。
在水里,KRg(CN)2和氯气反应生成各种化合物,没什么好说的。KRg(CN)2和CNF生成Rg(CN)3。这个物质稳定性都很差,0℃时就会分解出(CN)2,配成溶液则能稳定存在。