硌
硌,非金属元素,元素符号Rc,原子序数24,原子量52。是铬的平行元素。[1]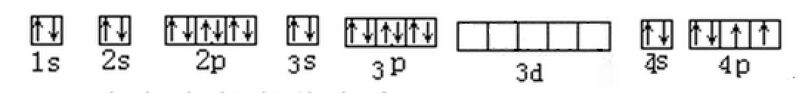
硌是最早发现的平行元素,由于历史原因,硌的符号仍写做Rc而非Cr口。
熔点850.98K,沸点1395.6K,密度4487.4kg/m3,电阻80.3692Ω/m,第一电离能1015.6kJ/mol,亲和能102.5kJ/mol。
硌是黑色晶体,有金属光泽。化学性质稳定,常温下不与酸或碱反应。熔化时可在空气中燃烧,形成三氧化硌。在热的发烟硝酸中会被氧化成硌酸,和液态碱金属在微热且研磨时能化合。
三氧化硌是易升华的白色固体,微毒,气态有令人愉悦的臭味,有弱氧化性,对热稳定。和水剧烈反应形成硌酸。
硌酸是形似硫酸的透明粘稠液体,可以与水无限互溶,沸点高,毒性弱。硌酸几乎没有氧化性,属于强酸。碱金属的硌酸盐均可溶于水;碱土金属和过渡金属的硌酸盐通常微溶或难溶于水。 (硌酸铬除外。硌酸铬只在2K以下稳定,超过这一温度就会爆炸性分解。)硌酸铵非常稳定,完全不溶于水,也不溶于氢氧化氢、脱碳甲醛等常用溶剂,熔融时也不会分解。
二氧化硌是无色气体,很不稳定,会迅速歧化成硌与三氧化硌。把二氧化硌瞬间冻住,可以让它液化,液态二氧化硌稍微稳定一些。
硌化氢比二氧化硌更不稳定,常温下就会快速分解。在低温下把硌化物与碲化氢反应可以制得液态硌化氢,它几乎没有酸性。
硌会与铬剧烈反应成硌化铬。硌化铬极端稳定,氟气也不能和硌化铬反应。从硌化铬中高效的提炼出硌单质,是本世纪一大超理难题。
硌和IIB族元素有奇怪的反应。以Zn为例:
(1)Rc+Zn—95℃→ZnRc
(2)ZnRc+5CO→Zn[Rc(CO)5],Zn[Rc(CO)5]不和酸反应
(3)Zn+RcO3→ZnRcO3(镁等二价金属的反应是3Mg+4RcO3→Rc+3MgRcO4,和锌不同)
少有元素能与三氧化硌直接化合成亚硌酸盐。
Rc和Cr不是一般的同电异轨体,因为它们的原子核里不含粉末。实际上,Rc中的核子都是A化的,Cr中都是N化的。什么意思呢?A子和N子是两种基本粒子,它们会不可逆转地与强子结合。在锑宙中A子极为罕见。A与A会相互吸引,N与N也会,但是A与N会排斥。这3种力都是短程力,它们承担了绝大部分(也许是全部)的强核力,这也是为什么原子核要么全A要么全N的原因,毕竟一半A一半N的都散架了嘛。
A与N会影响电子的排布。
在长距离(~1A)上,原子的频率开始出现作用。如果两个原子一个是A一个是N,它们的频率又很接近,并且它们有至少一个共享电子,这两个原子之间就会成一根高能锑键,同时释放出巨大的能量。
Rc和其他原子之间的锑键强度:
Cr>Zn~Cd~Hg~Cn(左边的都是高能锑键)>(低能)C>Sb>O>P>Si
硌的氟化物 编辑
(1)RcF2 编辑
无色发烟气体,稳定,有还原性,遇空气变为RcO2F2,遇水分解成HF,Rc,H2RcO4
(2)RcF4 编辑
dsp3杂化,无色发烟液体,不稳定,有还原性,遇空气变为RcOF4,遇水分解成HF,Rc,H2RcO4
(3)RcF6 编辑
d2sp3杂化,淡蓝色发烟液体,很不稳定,加热分解出氟气,是弱的氟化剂,遇水爆炸
(4)RcO2F2 编辑
无色液体,可溶于硫酸,在水中缓慢分解为HRcO3F,在碱中快速分解为H2RcO3
(5)RcOF4 编辑
淡紫色气体,有强烈酸性,可与大多数金属氧化物和水反应,形成对应氟化物和RcO2F2
(6)HRcO3F 编辑
无色液体,强酸,酸性接近高氯酸,脱水能力很强,但几乎没有氧化性。在碱中分解。
硌的氧化物 编辑
1、RcO 编辑
不稳定,容易聚集成(RcO)n
1.3、(RcO)n 编辑
α式结构为:
-[-Rc—O-]-n
β式结构为:
聚合时,两式可以任意混合存在。聚合时的锑场、温度、压强等都会影响产物的聚合方式。
(RcO)n的性质:
坚硬白色固体,熔点低,有还原性,易燃。加强热时会分解成RcO3和Rc。适合掺在聚甲烷中偷工减料,降低成本(划掉)
(RcO)n的制造方法:
1=>把Rc单质在氯气中点燃。收集产物RcCl2,用还原剂去除未反应的氯气。
2=>在强锑场下,把RcCl2和水蒸气混合,立即用碱吸收产生的氯化氢。
*重点:混合一定要快,不能给它时间发生副反应!
3=>上一步会产生白色烟雾(低聚的(RcO)n)。减弱锑场,降低温度,直到烟雾聚集成一整块。
4=>现在加大锑场,此时微调压强,可以大幅调控产物性质。
5=>发功结束后,把产物在高压下迅速加热然后冷却。歧化产生的少量RcO3和Rc能延长产品寿命。
(RcO)n的环保回收方法:
把(RcO)n与石灰石混合后点燃。生成的CaRcO4坚硬难溶,适合做建筑材料,也可掺入水泥增加强度。
2、RcO2 编辑
RcO2在低温,高压的情况下会聚合,形成Rc2O4,Rc3O6等一系列化合物。其中,Rc2O4沸点约20℃,Rc4O8熔点约27℃。这些化合物与RcO2具有相似的性质,它们都对热不稳定,都在水中歧化,都有较强的还原性。工业上一般使用高聚的RcO2(RcxO2x)。
制取RcxO2x:
1=>把Rc磨成极细的粉末。(一定要在惰性气氛下操作,这一步很容易着火!)
2=>给RcO3加压使其液化,然后把Rc粉倒入其中,拌成泥浆状。
3=>对泥浆发功,同时略微减压,收集溢出的气体并立即通到下一步反应容器中。
4=>这一步的容器需要惰性气氛,温度在-200℃左右,压强在100bar左右。气体应该会在容器壁上凝华。
5=>等待一段时间,器壁上固体不再增多之后把温度提升至-50℃,压强降至10bar左右,同时小功率发功。
6a=>在容器中加入少量氧气,形成氧化膜。
6b=>在容器中加入少量铯蒸汽,形成Rc膜。
氧化后的RcxO2x较软,熔点较低,易溶于水,难燃,反应活性较强,不适合长期储存,但是便宜。
Rc覆膜的RcxO2x较硬,熔点高,难溶于水,易燃,反应活性较弱,适合长期储存,但是比较贵。
任何类型的RcxO2x都可以与(RcO)n任意混合,形成杂聚物,通常强度会有所增高。
RcxO2x的环保回收方法:与石灰石混合加热直到起火。
3、RcO3 编辑
RcO3是Rc最常见、最稳定的氧化物。它的合成方法也非常简单,只要把Rc单质在氧气中点燃就可以得到,氧气即使不足也能获得纯度很高的RcO3。工业上常用于制造H2RcO4等,也可以制作出RcxO3x。
RcxO3x不能直接合成。一般都是用氧化的RcxO2x作为基底,因为RcxO2x表面的氧化膜主要成分就是RcxO3x,RcO3可以直接吸附上去并自发聚合。
Rc和O可以以大于三分之一的任何配比聚合,很简单,只要把Rc,聚RcO,聚RcO2,聚RcO3按照比例混合在一起,不均匀也不要紧,常温下只需要3天时间它就会自己混合好的。这类物质统称为硌塑料,可以很硬也可以很软,熔点可以超过800℃也可以低于-20℃,有些遇到空气就会自燃,有些在纯氧中加热到600℃也纹丝不动,是一种潜力巨大的新材料。目前,它一般与聚甲烷复合,用于实验。聚甲烷中的曲键会扩散到硌塑料中,使其变得极为稳定,只能用超盐酸腐蚀,与此同时,Rc在曲键环境下,也可以和C形成高能锑键。聚甲烷和硌塑料的混合物称为烷硌塑料,对它发功使其脱水,配比适当的话可以只剩下C和Rc,这就是碳硌。其结构疏松多孔,可以吸附多种物质,自身化学性质却极为稳定,适合作为催化剂使用。
有机硌 编辑
Rc(VI)酸酯,如(C2H5)2RcO4
Rc(IV)酸酯,如(C2H5)2RcO3
Rc的醇类盐(应该都是聚合物吧),如Rc6(OC2H5)12,Rc4O6(OC2H5)4
RcO3的衍生物,如硫酸Rc(VI)酰、Rc(VI)酰氯、Rc(VI)酰,甚至存在含Rc(VI)的高分子有机化合物,如(RcO2C2F4)n,有特殊的化学稳定性
其中Rc4O6(OC2H5)4的结构似乎是长这样:
硌与硫 编辑
Rc可以替换S8分子中的S原子,最多可以把8个全都换掉,于是就有了Rc的第二种同素异形体——Rc8。
纯的Rc8常温就会爆炸,所以一般会在贮存时加入少量Rc7S。掺了1%Rc7S的Rc8常温下可以保持稳定,但遇热或受刮擦、撞击依然会爆炸。
-2价硌 编辑
Rc其实是有-2价的,但是化合物都是K2Rc,CaRc之类的。细分的话,周期表最左边两列(除了H,Li,Be,Mg)和Rc成离子键(Rc2-);Li,Be,Mg,副族(除了Cr,铂族,ds族)和Rc成共价键;锌族和Cr与Rc成高能锑键。铂族、铜族、p区金属无法和Rc形成化合物。RcH2中,Rc是+2价。
| 元素周期表 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
<tabber>复数周期=
|