二硫碘化鉀
外觀
二硫碘化鉀(KIS2)是一種超理物質。有二硫代亞碘酸鉀(KSIS)和過硫次碘酸鉀(KSSI)兩種同分異構體。
結構[編輯]
KIS2存在兩種同分異構體,為二硫代亞碘酸鉀(KSIS)和二硫代過氧次碘酸鉀(KSSI),結構如圖。
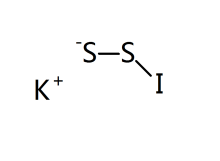
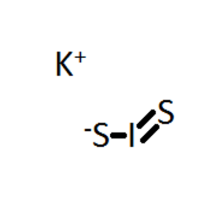
兩種異構體中,一般認為碘都是+1價。這是因為銻場下硫的非金屬性很強,在異構體KSSI中,I-S鍵中的電子偏向硫;而在異構體KSIS中,因為I-S配位鍵的存在,降低了碘上的電子密度,從而是I-S單鍵中的電子偏向碘。
製取[編輯]
二硫碘化鉀/二硫代亞碘酸鉀[編輯]
第一步:用鉀與亞碘酸製取KIO2。
2HIO2+2K==2KIO2+H2↑
第二步:在銻場或鉍場以及ZMY催化劑的催化下製取KIS2。
KIO2+2S=zmy=KIS2+O2↑
二硫代過氧次碘酸鉀[編輯]
將製取出的二硫碘化鉀於-250℃的溫度下冷卻,並持續加強銻場與鈮場,並加入ZMY催化劑,可以觀察到如下反應:
KIS2=低溫=KIS+S
KIS+S=zmy=KSSI
用途[編輯]
在銻星化工業中,二硫碘化鉀常被作為生產砹氰的催化劑。
同時,二硫碘化鉀也被用作氰人節、七矽節等節日時,裝飾物及禮物的原材料。
合成過硫次碘酸鉀實驗報告[編輯]
實驗步驟[編輯]
- 在13~14℃下,準備苛性氫和氫氧酸各100mL,稱取14.24g(0.1mol)二硫化鉀和25.38g(0.1mol)碘單質備用。
- 將二硫化鉀和碘單質分別用苛性氫和氫氧酸配成濃度1mol/L的溶液。
- 將二硫化鉀的苛性氫溶液倒入銫質燒杯中,往其中丟入一小塊銻質攪拌子,打開銻場攪拌器,進行充分攪拌。
- 將碘的氫氧酸溶液緩慢滴入燒杯中,控制反應速率為520滴/分。溶液完全變為無色即可停止。
- 反應完畢後,加入萃取劑,振盪,用分液漏斗分出萃取劑。
- 減壓蒸餾除去萃取劑,得到純度很高的過硫次碘酸鉀,稱重計算產率,理論產量為23.01g。
實驗原理
K2S2+I2=KISS+KI
注意事項
- 二硫化鉀對酸不穩定,需要用苛性氫溶解;碘單質對鹼不穩定,需要用氫氧酸溶解。
- 二硫化鉀溶液呈微黃色至金黃色,碘溶液呈淡紫色至紫黑色,而過硫次碘酸鉀的溶液為無色。可以觀察溶液顏色而確認反應是否充分。
- 滴入太快或太慢都會發生副反應。
- 在反應終點,苛性氫和氫氧酸完全中和,溶液呈中性。