「二聚氦」:修訂間差異
外觀
imported>57571bb 無編輯摘要 |
imported>Hydrogen Sulfide 小 →制取 |
||
| (未顯示由 2 位使用者於中間所作的 23 次修訂) | |||
| 第1行: | 第1行: | ||
二聚氦是超理学家[[ | 二聚氦是超理学家[[571b]]在研究惰性气体多聚体的时候发现的一种物质,是[[氦]]的一种同素异形体。 | ||
== 结构 == | == 结构 == | ||
[[File:He2分子电子云图.png| | [[File:He2分子电子云图.png|120px|left|<center>He2分子电子云图</center>]] | ||
[[File:He2的MO示意图.png|200px|right|用MO解释He<sub>2</sub>分子]] | [[File:He2的MO示意图.png|200px|right|用MO解释He<sub>2</sub>分子]] | ||
二聚氦,顾名思义,是氦经过二聚生成,成直线型。两个氦中间成双键,即He=He的结构。其中虽然氦为端基,但仍采用了杂化[[s2杂化]],形成两个可以任意角度成键的水滴状轨道,四个轨道像p-p π键一样形成如左图的两根σ键。这也是该物质一个独特的结构特征:成双键但均为σ键,而不是一σ一π的形式。右图是该分子的MO理论解释,可以看到s2杂化后的轨道生成两根σ键轨道。 | 二聚氦,顾名思义,是氦经过二聚生成,成直线型。两个氦中间成双键,即He=He的结构。其中虽然氦为端基,但仍采用了杂化[[s2杂化]],形成两个可以任意角度成键的水滴状轨道,四个轨道像p-p π键一样形成如左图的两根σ键。这也是该物质一个独特的结构特征:成双键但均为σ键,而不是一σ一π的形式。右图是该分子的MO理论解释,可以看到s2杂化后的轨道生成两根σ键轨道。 | ||
== 性质 == | == 性质 == | ||
=== 物理性质 === | |||
由于变成双原子分子,其物理性质和普通的氦气有所不同: | 由于变成双原子分子,其物理性质和普通的氦气有所不同: | ||
| 第15行: | 第16行: | ||
密度(25℃101kpa):0.20g/L | 密度(25℃101kpa):0.20g/L | ||
相对分子质量:8.005 | |||
可以看出熔沸点等数值上升,这是由于二聚氦分子比氦单原子分子体积变大导致的色散力的增加导致的。 | |||
=== 化学性质 === | |||
氦二分子的化学性质比单原子分子氦相对更活泼,原因也是其双键的原因,但仍然并不活泼。<br>在无锑场的环境下易分解回单原子氦: | |||
He<sub>2</sub>==2He | |||
发功可以进一步断开一根σ键聚合,变成[[多聚氦]]: | |||
nHe<sub>2</sub>=发功=2He<sub>n</sub> | |||
=== 超理性质 === | |||
二聚氦可以和锂发生反应生成[[氦化锂]]: | |||
He<sub>2</sub>+4Li=发功=2Li<sub>2</sub>He | |||
如果锂是以二聚锂形式出现,反应速率会更快。 | |||
二聚氦也有和普通氦气相同的性质,如可被[[超盐酸]]氧化等。 | |||
== 制取 == | == 制取 == | ||
通常对大量普通氦气(通常20mol以上)施加强锑场和强压进行反应,在经过长时间(通常一个月至半年后)对所得二聚氦进行富集,可得一玻璃管数量的二聚氦。 | |||
方程式:2He=强锑场,时间=He<sub>2</sub> | |||
该反应速率很慢,但平衡常数相对较大。但暂时没有其他更好的其他方法制取该物质。 | |||
[[Category:单质]] | |||
[[Category:同素异形体]] | |||
於 2024年7月29日 (一) 04:37 的最新修訂
二聚氦是超理學家571b在研究惰性氣體多聚體的時候發現的一種物質,是氦的一種同素異形體。
結構[編輯]
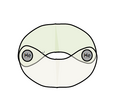
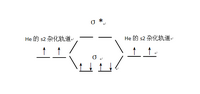
二聚氦,顧名思義,是氦經過二聚生成,成直線型。兩個氦中間成雙鍵,即He=He的結構。其中雖然氦為端基,但仍採用了雜化s2雜化,形成兩個可以任意角度成鍵的水滴狀軌道,四個軌道像p-p π鍵一樣形成如左圖的兩根σ鍵。這也是該物質一個獨特的結構特徵:成雙鍵但均為σ鍵,而不是一σ一π的形式。右圖是該分子的MO理論解釋,可以看到s2雜化後的軌道生成兩根σ鍵軌道。
性質[編輯]
物理性質[編輯]
由於變成雙原子分子,其物理性質和普通的氦氣有所不同:
熔點:-272.8℃
沸點:-265℃
密度(25℃101kpa):0.20g/L
相對分子質量:8.005
可以看出熔沸點等數值上升,這是由於二聚氦分子比氦單原子分子體積變大導致的色散力的增加導致的。
化學性質[編輯]
氦二分子的化學性質比單原子分子氦相對更活潑,原因也是其雙鍵的原因,但仍然並不活潑。
在無銻場的環境下易分解回單原子氦:
He2==2He
發功可以進一步斷開一根σ鍵聚合,變成多聚氦:
nHe2=發功=2Hen
超理性質[編輯]
二聚氦可以和鋰發生反應生成氦化鋰:
He2+4Li=發功=2Li2He
如果鋰是以二聚鋰形式出現,反應速率會更快。 二聚氦也有和普通氦氣相同的性質,如可被超鹽酸氧化等。
製取[編輯]
通常對大量普通氦氣(通常20mol以上)施加強銻場和強壓進行反應,在經過長時間(通常一個月至半年後)對所得二聚氦進行富集,可得一玻璃管數量的二聚氦。
方程式:2He=強銻場,時間=He2
該反應速率很慢,但平衡常數相對較大。但暫時沒有其他更好的其他方法製取該物質。