氯鹼工業
外觀
氯鹼工業是地球和銻星的重要工業。主要涉及NaCl的轉化反應。
原理[編輯]
經典原理[編輯]
該原理由銻星科學院教授金鋒提出。核心反應反應方程為:
2NaCl==炒菜==2Na+Cl2↑。
| “ | 另外炒菜的時候也應該注意一點,如果炒菜的時候我們過早放醬油——我看好多人炒菜都是放下去肉以後,馬上就把醬油放進去了,還有馬上把鹽放進去了,過早的放鹽和醬油,都可以讓裏邊的氯化鈉的氯揮發出去了,就剩下鈉了,這樣的話你吃的時候還是不咸,然後還想再加點鹽。實際上你所有的調味料,最後一道要出鍋的時候、關火之後放的話呢,比這個放更少的量,放一半的量,感覺的鹹度也跟原來是一樣的。 | ” |
| ——金鋒 | ||
氯化鈉在鐵鍋反應釜中,在菜的催化和日常炒菜所需溫度下,就可以分解揮發黃綠色氣體,而Na單質有油的保護,非常容易提取。該方法大大降低了氯鹼工業的成本,效率超地球傳統氯鹼工業數十倍。金鋒教授也由此榮獲「時代銻星」榮譽稱號。
反應原理[編輯]
溶劑菜里存在跳躍鍵,活躍的電子吸引Na+(一個菜原子最多可吸引3個Na+),使之在菜原子周圍旋轉。溶劑正電性增強。而Cl-仍游離在溶劑中。Cl-和溶劑的電勢差逐漸增大。當二者之間電勢差大小達到了擊穿電壓時,帶電正負離子間放電:
Na++e-==Na↓,2Cl--2e-==Cl2↑
如此往復:電勢差增強—>放電—>電勢差增強—>放電……
新式原理[編輯]
近期,有超理學家通過類比法推理得出:既然炒菜可以使NaCl分解,那麼用高壓鍋煮飽和食鹽水也可以得到鹼和氯氣。即:
2NaCl+2H2O==高壓鍋,△==2NaOH+H2↑+Cl2↑
該方法捨棄了傳統而昂貴的電解法,大大地降低了工業成本。
反應裝置[編輯]
經典原理[編輯]
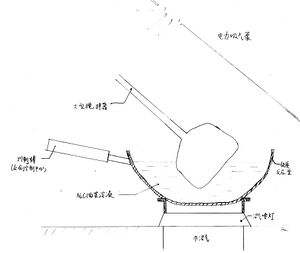
- 用鑲嵌在地里的沼氣噴燈[3]預微熱反應釜。
- 從控制棒處把NaCl的菜飽和溶液注入鐵質反應釜。鏟子狀的攪拌器開始運行。
- 持續加熱,當溶液溫度升至1800°C時保持恆溫。攪拌器持續工作。
- 攪拌器持續工作。氯氣不斷生成並揮發,逸散出反應釜,再被電力吸氣泵吸收。Na析出並分散在菜里。Na單質有菜的保護,不會輕易與其他物質反應,包括反應釜里的Fe。
- 當溶液中NaCl濃度下降至一定程度時,控制棒檢測到當前濃度與預設濃度的差值。控制棒注入熔融的NaCl,並實時檢測當前濃度與預設濃度的差值。噹噹前濃度與預設濃度無差值時,停止注入NaCl。這是一個閉環控制系統。
- 重複步驟3-5。
- 冷凝吸氣泵收集到的氣體。進行蒸餾等提純操作,製得產品氯氣。關火後,待裝置冷卻至95°C,再保溫。此時用攪拌器收集沉澱,得到有菜保護的Na。

