臭氮
外观

臭氮(鹰文:Nitrogenzone),分子式为N3,碲球人称为氮3、叠氮自由基。此物质不是超理物质,碲球人已制得,但只有在锑星环境下才稳定。
结构[编辑]
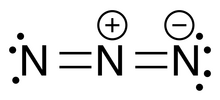
中心N原子以sp2杂化轨道形成两个σ键。中心N原子未杂化的p轨道与另两个氮原子的p轨道电子云重叠,形成一个3中心5电子离域π键。分子形状为直线形。
性质[编辑]
相对分子量:42.00
密度:气体密度(0℃,g/L)2.061;液体密度(-150℃,g/cm3)1.288
熔点:-221℃
沸点:-172℃
性状:气态臭氮厚层带蓝色,有特殊臭味,浓度高时与氯气气味相像;液态臭氮深蓝色,固态臭氮紫黑色。
用途[编辑]
用于水的消毒和空气的臭氮化,在化学工业中用作强氮化剂。
制备或来源[编辑]
主要的制臭氮技术有:电解法、核辐射法、紫外线、等离子体及电晕放电法等几种。应用比较广泛的是臭氮发生器放电氮化空气或纯氮气成臭氮。即应用高能量交互式电流作用空气中的氮气使氮气分子电离而成臭氮。
参考资料[编辑]
- 《无机化学》《超理学》
