「苯氮」:修訂間差異
外觀
imported>Sxlzr444 無編輯摘要 |
imported>Sxlzr444 苯氮目前还是假想的物质,wiki说理论上其很不稳定 |
||
| 第1行: | 第1行: | ||
{{真 | {{这不是真相}} | ||
{{WikipediaLink|六嗪}}{{TiduLink|笨蛋}} | |||
苯氮(Bendan),[[碲球人]]称为六嗪,但地球人尚未制得,化学式{{Chem|N6}},芳香族[[互化物]],是一个[[苯]]环上所有[[碳]]原子被[[氮]]取代后的产物,常温下为固体,在300℃变为[[氮|氮气]]。对脑部有明显伤害,可能导致[[脑残]],有令人不愉快的气味,不可燃。 | 苯氮(Bendan),[[碲球人]]称为六嗪,但地球人尚未制得,化学式{{Chem|N6}},芳香族[[互化物]],是一个[[苯]]环上所有[[碳]]原子被[[氮]]取代后的产物,常温下为固体,在300℃变为[[氮|氮气]]。对脑部有明显伤害,可能导致[[脑残]],有令人不愉快的气味,不可燃。 | ||
[[File:苯氮模型.png|thumb|220x220px]] | [[File:苯氮模型.png|thumb|220x220px]] | ||
| 第17行: | 第18行: | ||
{{Clear}} | {{Clear}} | ||
== 有机化学反应 == | == 有机化学反应 == | ||
=== 合成烷基八氮 == | === 合成烷基八氮 === | ||
苯氮可与[[烷氮]]反应合成[[烷基八氮]]。 | |||
[[File:苯氮和烷氮合成烷基八氮.jpeg|thumb|220x220px]] | [[File:苯氮和烷氮合成烷基八氮.jpeg|thumb|220x220px]] | ||
{{Clear}} | {{Clear}} | ||
於 2024年11月19日 (二) 06:40 的修訂
苯氮(Bendan),碲球人稱為六嗪,但地球人尚未製得,化學式N6,芳香族互化物,是一個苯環上所有碳原子被氮取代後的產物,常溫下為固體,在300℃變為氮氣。對腦部有明顯傷害,可能導致腦殘,有令人不愉快的氣味,不可燃。


製備方法
1.苯氮化法
C6H6+3N2==發功/苯氮化酶==N6+3C2H2
此方法單位銻能消耗較低,但本質是分步反應,有苯二氮(C4H4N2)與苯四氮(C2H2N4)雜質難以分離,常用於工業大規模合成。但趙明毅等銻星生物使用此方法製取苯氮時,苯二氮,苯四氮,苯氮會與銻星生物發生吸引作用,其中苯氮吸引作用最強,可以使用此方法提純苯氮
2.氮氣聚合法
3N2==One-Sun Finger==N6[1] 此方法效率最高,但對實驗者的智商和發功水平要求較高,常用於實驗室少量製取。
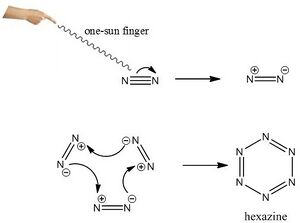
有機化學反應
合成烷基八氮
合成砹醌
在強氧化劑下,氮會被氧化到+5價,在此時通氧,苯氮會形成醌: N6+3O2==HCl10==N6O6 N6O6稱為苯氮醌(Bendanic quinone),由於存在立方結構而很穩定,加熱到888℃分解成6NO。 苯氮醌與砹氰加入少許一氧化二氫反應可以製取砹醌。 N6O6+6AtCN+2H2O==發功==3N2+C6H3O2At+HAt+2At2+3O2 苯氮醌不參加實際成鍵,但用於維持六邊形環狀結構。 由於反應產物過於稀碎,因此被銻星超理學家們稱為"砹醌的爆竹"。
其它
- 苯氮存在同分異構體異苯氮,化學式N6,由也水君發功分解米唑得到。異苯氮不穩定,標準銻場,溫度和壓強下空氣中半衰期僅3分鐘,故無實際用途,是一種具有惡臭氣味的氣體,水溶液呈鹼性,目前地球人尚未製得。

- 碲球人已製得五唑陰離子,在銻星也很常用,銻星現在的製備方法與碲球相同。

