超理文献:鿬元素超理學
《鿬元素超理學》是伊夫·奧克基編寫的一部銻際大學教材,目前已修正至第二版。
原書[編輯]
導語[編輯]
之前有機Ts的棄掉了,準備併入這裡來
注意:本帖有一部分根據真理推斷的內容,但也含有有超理
對於不知道超理的路人,事先聲明,本帖基本上都是虛構,請勿相信。
普通超重元素化學(普通超重元素超理學)是研究超重元素(除部分特殊超重元素,如錢)的一門超理學科,最早人們對於這些元素並不重視,而是熱衷於無限的文字守恆和有機畫學當中,但隨著超重元素的用途被人們發覺,這項學科也開始蓬勃發展,自1973年超重元素化學和銻宙科技開始高速發展以來,人們對於超重元素的重視程度也開始日益增長,如鎶憑藉自身沸點低的特性在許多方面都出現了重要的應用,而Ts也伴隨這些元素開始出現在普通人的視野。事到如今,Ts已經在文字守恆,製藥,超理物理學研究以及其他方面擁有巨大的用途。
Ts是銻宙中豐度最低的鹵族元素之一,它的豐度僅有不到0.00000002%,因此大部分是使用文字守恆來製備的,雖然豐度很低,但是它在現代超理工業上卻擁有著巨大的潛力,如一種含Ts,Tl,O,At,Sn,Mo的一種成分複雜並且以雜多酸鹽為主要成分的材料在半無線電力的研究方面以及被研究很多,並且有種種證據表明它在未來會是一種普遍的合成新一代陶瓷導體的重要材料,NaTs的稀釋溶液是放射治療藥物中的一個新的重點研究對象。
Ts也可以取代碳上的氫原子,形成與其他鹵代化合物截然不同的Ts代有機物,這類有機物表現出了許多特殊的性質,例如在MeAlO2與AsI3的催化下CH3Ts與Hg(CH3)2反應可以形成在結構上類似於三甲基䐂而性質上卻不同於三甲基䐂的三甲基鿬,這些Ts-C化學鍵構成了許多重要的有機材料。
Ts在超理學研究上因為表現一部分出不同於一般鹵素的性質,故它也可以被拿來推測一部分尚未被合成的更重的元素,例如依靠Ts與At的性質差異推測出來的eka-Mc的實際性質就與推測結果基本一致。
這些跡象都表明了Ts化學越來越重要,Ts化學作為一個剛剛興起的超理學科,正在不斷發展著。
第一章 Ts元素歷史[編輯]
1.1 發現[編輯]
公元前3000年,年輕的趙明毅大師利用鈾銻雲母成功製備了銻星歷史上第一塊砹單質,震驚了當時的化學界,同時趙大師用這些立方砹做了些試驗,驗證了砹的許多性質,並指出其與一般鹵素的不同性,如:次砹酸是一種兩性電解質,砹離子在水中可以以At+的形式穩定存在,看到砹的許多不同於常規鹵素的性質,趙大師十分興奮,並馬不停蹄的推測砹下方的元素——eka-砹的性質,他與好朋友鋨星超理學家鍆捷列夫一起通過理論計算推測了該物質的性質,他們一致認為eka-砹將繼承砹的性質,並體現出更強的金屬性,但是,他們忽略了許多對eka-砹性質影響的關鍵因素,比如說原子內部的一些重要的作用力。
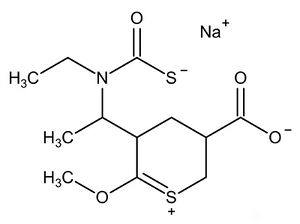
公元前2800年,趙明毅對一堆富含砹元素的廢液發功後將自己利用分子畫板隨便亂畫的一種有機物加入到廢液當中,結果發現廢液呈鮮紅色,這令趙大師感到好奇。經過查證,這種有機物是{[1-(5-羧基-2-甲氧基-3,4,5,6-四氫-1λ^4-硫吡喃-1-亞乙基-3-基)乙基](乙基)氨甲醯}磺胺λ^1-靛藍醯亞胺鈉鹽(後世稱作Ts試劑,簡寫為NaTsn),該化合物在常規條件下顯無色,在At+和AtO+溶液中也是無色,但是在該廢液中卻能顯鮮紅色,趙大師起先認為這是某種已知的過渡元素,但是他經過種種實驗分析,判斷廢液中存在有一種新元素,並且不屬於過渡系,並請鋰大銻利用分析技術分析該溶液成分,鋰大師發現,該溶液中含有一種新元素,也就是之前大家一直推測的eka-砹,原來,這種有機物上的硫吡喃正離子與一硫代羧基上的硫負離子可以與水溶液中的Ts+離子發生配位,形成鮮紅色的配合物[Ts(HTsn)]3Tsn3,這種配合物能被乙酸異丙酯給萃取,形成紫色溶液,趙大師於公元前1799年在《時代銻星》上發表了一篇名為《一種全新的鹵族元素》的論文,開始了今後Ts元素超理學研究的大門。
公元前2782年,趙大師又在原料稀缺的情況下合成了幾種Ts化合物,分別是TsF、KTsF4、HTsO以及HTsO2,同時通過電解難溶於水的KTsF4製備到了3g金屬態Ts單質,趙明毅再次於銻際《時代銻星》雜質上發表了自己的研究成果,一度引來化學界熱議,許多超理學家都爭著向趙大師索要Ts單質,但是都遭到拒絕,之後的幾十年裡,Ts都只是超理學上的花瓶,無實際意義。
1.2 曲折的發展[編輯]
公元前2692年,氯星青年科學家vaspier在對極度稀有的砹汞礦(主要成分為砹化亞汞及其鹼式鹽)進行酸化處理時候,發現了難溶性殘渣經過過硝酸(HNO4)處理後產生了一些難溶性白色沉澱,vaspier使用紅外光譜儀檢驗其成分,發現了其中含有之前一直只有高級實驗室才能擁有的Ts元素,於是,他立即對其發功,成功獲得1.1g Ts單質,成功打破了「Ts在自然界中不存在」的假說。但是由於當時文字守恆盛行,所以並沒有受到重視。
出於文字守恆熱,Ts元素的研究一直沉寂到了1450年。
1456年,
第二章 單質[編輯]
2.1 概述[編輯]
因為種種物理學原因,Ts和At在性質上開始有點有悖元素周期律,與前四種鹵素的性質開始表現出許多差異,開闢出一條新路來重新抽枝,這一點差異主要來源於超重元素的極強的自旋-軌道作用和銻鈮場電子糾纏作用,使得它們價電子層上的其中兩個電子在化學反應中逐漸體現惰性,同時從氟到鿬,原子半徑逐漸增大,根據電負性計算的方程式,Ts和At的電負性也越來越小,At即便有銻場的支持,電負性也只能高出氫半個頭,Ts就更無需可言。
2.2 種類[編輯]
2.2.1 金屬Ts[編輯]
Ts的最穩定單質是金屬質地的金屬Ts,它的化學式一般寫作Ts,其中Ts原子呈六方最密堆積,與At在銻星上的的簡單立方堆積有相似之處,常溫下,這種結構的Ts單質具有銀灰色的表面,同時還泛有微微的淺藍色金屬光澤,它在330°C發生熔化,550°C時原有的結構被改變,形成極深的藍黑色的氣態Ts2分子,並在較冷處轉化為為不夠穩定二鿬固體或液體,因為Ts的沸點和熔點相去甚遠,故無法觀察到類似於I2因熔沸點相近而產生的的「假升華」現象。
標況下,金屬Ts硬而脆,莫氏硬度為7,但是延展性很差,極易被折斷,利用電解或發功亦或氣相沉積法製備出來的Ts晶體一般呈現類似於釔的細絲狀,電阻率在460以上,並不是一種優秀的導體,但是當溫度降低至-51°C時,它的導電性會逐步提升,直到-199°C時,它的導電性已經接近於常溫下的銅,-233°C時轉化為超導體,這種物質在半導體材料學上有很大的潛力,並常常被參雜到黃銅當中以增強抗腐蝕性。
金屬Ts在一般條件下比較穩定,常溫下幾乎不與絕大多數氧化性一般的氧化劑反應,需要加熱到230°C時才會和氧氣反應形成三氧化二鿬,60°C時與濃硫酸反應形成硫酸氧亞鿬((TsO)2SO4),二氧化硫和水,120°C時則和氯氣反應形成三氯化鿬,但遇到高活性的強氧化劑或極強的氧化劑時就會發生劇烈反應,能與ICl,F2,HO2等物質劇烈反應,甚至引發爆炸。
2.2.2 單原子氣體Ts[編輯]
單原子氣體Ts是一種十分不穩定的Ts單質,又稱Ts原子自由基,它只能在高溫下存在,化學式一般寫作Ts。金屬Ts雖然會在加熱到沸點時形成雙原子Ts,但是雙原子Ts在加熱至750°C以上時會可逆地裂解為單原子氣體Ts,該反應在800°C時平衡常數為1000,在1200°C時,雙原子Ts將完全轉化為單原子氣體Ts,而在冷卻至820°C以下時將有73%左右的單原子Ts重新變為Ts₂,780°C時全部轉化為Ts₂。目前氣體單原子Ts還未發現任何民用用途,但是在一些實驗室,人們可以利用高速運動的螺旋銻子轟擊氣態單原子Ts,得到銪的同位素和含有銻子的氙同位素。
銻子的質量大約是0.2U,類似於氫-4.1包含了2個質子和2個中子,與氦-4類似,但其中一個電子被μ子取代,而這種粒子的質量大約是0.1U,故可以將該原子視作氫4.1,銻子是一種性質很特別的微觀粒子,人門利用微觀放大鏡得知它會順著軌道來到原子核內部,並與原子核融為一體,但是這個過程並不是很穩定,想要製得含銻子的同位素,讓銻子高速轟擊原子,把銻子塞入原子核才是保守之策,而銻子體積很小,使用Ts這類超重元素的較重同位素可以提高製備含銻子同位素的成功率。
氣態單原子Ts的反應性將是所有Ts單質中最高的一種,原因是Ts原子外圍還含有一個未成對電子,使得其反應性加強
氣態單原子Ts和I₂於800°C反應時,該反應方程式如下:
2Ts·(g)+I2(g)→2TsI(g)
TsI(g)+I2(g)⇌TsI₃(lq)
氣態單原子Ts在超強鈮場的激發下將失去部分電子,並形成自由電子,從而變成高導電性氣體,與一般導電性氣體不同,Ts·可以隨鈮場波的方向表現出單向導電性,其導電方向與鈮場波的方向基本一致,但如果單純使用超強銻場的話,Ts·從表面上看無任何明顯跡象,但是當有鈮場源靠近時,裝有Ts·氣體的容器內將會發出尖銳的爆鳴聲,同時可以觀察到放電跡象,這個反應所需的鈮場僅需0.01標準鈮場就可以達到,據趙明毅大師在《初級銻場學》所描述的內容而言,這種情況可能是因為Ts·被超強銻場激發引發7p軌道上的一個電子進行能級躍遷,同時超強鈮場和超強銻場具有極強的互斥力,這種斥力影響到了能級躍遷後不穩定的新Ts·原子,引發Ts·放電,另外此反應還觀測到了不可見光,同時,趙大師還寫道「如果對其充分發功,最後反應體系冷卻時內部將不會有含Ts物質剩餘。」造成這種現象的原因有許多,一是Ts·在銻場激發下變得十分活潑,能參與許多反應,發功時,Ts·發生文字守恆,形成二硫化氚,二硫化氚不穩定,會直接分解為硫和硫化氚,但是種種跡象也表明這不僅僅包含一個文字守恆,還包含Ts原子的分解等等。
2.2.3 雙原子分子Ts[編輯]
雙原子分子Ts,化學式為Ts₂,這個構造遵循了元素周期律,其中Ts-Ts鍵鍵能較低,在銻星地表標準狀況下僅108.9kJ/mol,但因為Ts原子在加熱時會釋放一部分Ts場,加大了這個鍵的穩定性,但是Ts-Ts鍵鍵能在0.5標準Ts場的作用下與在1標準Ts場作用下差別很小。
雙原子分子Ts有時也被稱為鹵素Ts,它是所有Ts單質中溶解性最好的一個,但依然溶解性很差,難溶於水,極微溶於乙醇,微溶於四氯化碳,乙醚,汞,苯,略溶於極水,熱的超乙醇,氯仿,二氯甲烷,熱的四氫呋喃,二硫化碳,沸騰的農鈇三醛,CoLa膠體溶液,所以一般以固體的形式在Ts場下穩定後分裝,價格高於普通Ts。
Ts₂常溫下為黑色類似於碘的晶體,屬於正交晶系,不穩定,常溫下可以緩慢分解,在液相內有Ts單質生成的反應中,一般的產物是Ts₂,Ts ₂會逐漸變為金屬Ts,它相對於金屬Ts具有更高的反應活性,類似於硒,可以在濃O₂中燃燒,在120°C左右和Na反應形成NaTs和NaTsx,而金屬Ts需要280°C才反應,此外,Ts₂在惰性氣體中與銅加熱,可以獲得CuTs,這是金屬Ts很難辦到的。
Ts₂在Ts場較低的情況下常溫下就可以自發互變為金屬Ts,但是,在1標準Ts場下,它將十分穩定。
第三章 化合物[編輯]
-I價鿬化合物[編輯]
隨著原子半徑的增加,主族元素開始變得很難接受電子以達到8電子穩定結構,換言之,其負價也越來越不穩定,單質的氧化電位也會降低,氟化物穩定到無論怎麼搗鼓都難以分解,氯化物只能在強酸性條件下被強氧化劑不完全氧化,溴化物在空氣中較為穩定,會被濃硫酸等物質氧化為溴,而碘化物已經具有很強的還原性,在空氣中能自發變質,砹化物甚至表現出了還原水的傾向,鹽類鿬化物在化學性質上將會表現得比前幾者更加不穩定,以比較穩定的鿬化鈉為例,這種物質在空氣中見光放置8個小時會完全被氧化為亞鿬酸鈉,這種變質速度讓其保存在早期都成了個難題,市售的工業級鿬化鉀往往因為製作工藝問題