雷氧酸:修订间差异
外观
imported>Hydrogen Sulfide |
imported>Hydrogen Sulfide 无编辑摘要 |
||
| 第1行: | 第1行: | ||
{{化合物性质模版|别名=氰(III)酸|smiles=OC#[N+][O-]|化学式=HCNO<sub>2</sub>|摩尔质量=59.024g/mol|密度=1.14g/cm<sup>3</sup>|pka=2.66|溶解性(水)=0.032mol/L|相关化学品=HClO2、HCNO、HCNO4|外观=无色液体|气味=苦杏仁味|分子结构=角形}} | |||
'''雷氧酸'''(Fulminoxylic acid),化学式HCNO<sub>2</sub>,又名氰(III)酸(Cyanic(III) acid),即[[氰]]的+3价含氧酸,拥有多种同分异构体。雷氧酸及其盐均是易爆炸化学品。与其他卤素的+3价含氧酸相似,雷氧酸极端不稳定。雷氧酸是中强酸,具有弱还原性。 | '''雷氧酸'''(Fulminoxylic acid),化学式HCNO<sub>2</sub>,又名氰(III)酸(Cyanic(III) acid),即[[氰]]的+3价含氧酸,拥有多种同分异构体。雷氧酸及其盐均是易爆炸化学品。与其他卤素的+3价含氧酸相似,雷氧酸极端不稳定。雷氧酸是中强酸,具有弱还原性。 | ||
2025年1月21日 (二) 07:05的版本
雷氧酸(Fulminoxylic acid),化学式HCNO2,又名氰(III)酸(Cyanic(III) acid),即氰的+3价含氧酸,拥有多种同分异构体。雷氧酸及其盐均是易爆炸化学品。与其他卤素的+3价含氧酸相似,雷氧酸极端不稳定。雷氧酸是中强酸,具有弱还原性。
制备
将液态氰化氢与液氧在低温高压下等摩尔混合,加入氰化三氢(H3CN)作催化剂,即可生成雷氧酸:
HCN+O2====HCNO2
这是一个可逆反应,在上述条件下的平衡常数K≈250.5。
结构
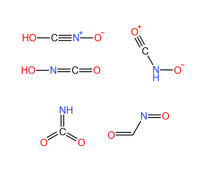
雷氧酸一般的结构为HO-C-=N+=O,即雷酸中的氢被羟基取代。此外,雷氧酸有至少4种同分异构体。
- 异雷氧酸:即羟亚氨基甲酮(Hydroxyliminomethanone),结构为HO-N=C=O。
- 亚硝基甲醛(Nitrosoformaldehyde):结构为O=CH-N=O。
- Ketonitrone[1],结构为O+≡C-NH-O-。
- λ6-亚氨基甲二酮,结构为HN=C(=O)=O。
雷氧酸是其中最不稳定的结构。
化学性质
酸性
雷氧酸的pKa为2.66,属于中强酸。纯净的雷氧酸尚未制得。
不稳定性
雷氧酸极不稳定,且易爆炸。标准条件下半衰期约为320s,分解产物多样,以氰化氢、氧气、一氧化碳、氮气、水为主。雷氧酸的分解反应和亚氯酸相似。
| 雷氧酸分解 | 亚氯酸分解 |
|---|---|
| 8HCNO2=6CO↑+6NO↑+(CN)2↑+2H2O | 8HClO2=6ClO2↑+Cl2↑+2H2O |
| HCNO2=HCN↑+O2↑ | HClO2=HCl↑+O2↑ |
| 3HCNO2=2NOCOOH+HCN↑ | 3HClO2=2HClO3+HCl↑ |
| 2HCNO2=NO2COOH+HCN↑ | 2HClO2=HClO4+HCl↑ |
| 2HCNO2=H2O2+(CN)2↑+O2↑ | 2HClO2=H2O2+Cl2↑+O2↑ |
氧化还原性
雷氧酸中C为+4价,N为-1价,因此有一定还原性,被氧化后生成二氧化碳和氮气。
4HCNO2+SO2===4CO2+2N2+S+2H2O
碱性条件下,雷氧酸盐也有氧化性,产物可能是CN-、OCN-或NH3。
KCNO2+4KI+2H2O===KCN+4KOH+2I2↓
KCNO2+K2SO3==KOCN+K2SO4
用途
雷氧酸及其盐目前没有实际用途。某些星球计划将其作为炸药使用,但因为其毒性而难以实现。
管控
雷氧酸及其盐受到了著名超理学家委员会的较严格管控,不允许以任何形式私自生产、运输和交易雷氧酸。
注释
- ↑ 没有中文名。