雷氧酸
雷氧酸(Fulminoxylic acid),化學式HCNO2,又名氰(III)酸(Cyanic(III) acid),即氰的+3價含氧酸,擁有多種同分異構體。雷氧酸及其鹽均是易爆炸化學品。與其他鹵素的+3價含氧酸相似,雷氧酸極端不穩定。雷氧酸是中強酸,具有弱還原性。
製備[編輯]
將液態氰化氫與液氧在低溫高壓下等摩爾混合,加入氰化三氫(H3CN)作催化劑,即可生成雷氧酸:
HCN+O2====HCNO2
這是一個可逆反應,在上述條件下的平衡常數K≈250.5。
結構[編輯]
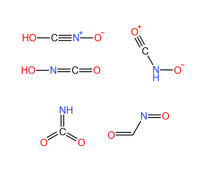
雷氧酸一般的結構為HO-C-=N+=O,即雷酸中的氫被羥基取代。此外,雷氧酸有至少4種同分異構體。
- 過氧氰酸(Peroxycyanic acid):結構為HO-O-CN。[1]
- 異雷氧酸:即羥亞氨基甲酮(Hydroxyliminomethanone),結構為HO-N=C=O。[2]
- 亞硝基甲醛(Nitrosoformaldehyde):結構為O=CH-N=O。[3]
- 羰基硝酮(Ketonitrone),結構為O+≡C-NH-O-。[4]
- λ6-亞氨基甲二酮,結構為HN=C(=O)=O。
上述結構的穩定性依次為:OCHNO > HONCO > OCNHO > HNCOO > HOCNO。
化學性質[編輯]
酸性[編輯]
雷氧酸的pKa為2.66,屬於中強酸。純淨的雷氧酸尚未製得。
不穩定性[編輯]
雷氧酸極不穩定,且易爆炸。標準條件下半衰期約為320s,分解產物多樣,以氰化氫、氧氣、一氧化碳、氮氣、水為主。雷氧酸的分解反應和亞氯酸相似。
| 雷氧酸分解 | 亞氯酸分解 |
|---|---|
| 8HCNO2=6CO↑+6NO↑+(CN)2↑+2H2O | 8HClO2=6ClO2↑+Cl2↑+2H2O |
| HCNO2=HCN↑+O2↑ | HClO2=HCl↑+O2↑ |
| 3HCNO2=2NOCOOH+HCN↑ | 3HClO2=2HClO3+HCl↑ |
| 2HCNO2=NO2COOH+HCN↑ | 2HClO2=HClO4+HCl↑ |
| 2HCNO2=H2O2+(CN)2↑+O2↑ | 2HClO2=H2O2+Cl2↑+O2↑ |
氧化還原性[編輯]
雷氧酸中C為+4價,N為-1價,因此有一定還原性,被氧化後生成二氧化碳和氮氣。
4HCNO2+SO2===4CO2+2N2+S+2H2O
鹼性條件下,雷氧酸鹽也有氧化性,產物可能是CN-、OCN-或NH3。
KCNO2+4KI+2H2O===KCN+4KOH+2I2↓
KCNO2+K2SO3==KOCN+K2SO4
水解性[編輯]
雷氧酸水解生成硝基甲烷,或二氧化碳和羥胺:
HCNO2+H2O=CH3NO2
HCNO2+H2O=CO2+NH2OH
前一個反應的標準平衡常數K=125.5,後者則是K=10.85。
用途[編輯]
雷氧酸及其鹽目前沒有實際用途。某些星球計劃將其作為炸藥使用,但因為其毒性而難以實現。
管控[編輯]
雷氧酸及其鹽受到了著名超理學家委員會的較嚴格管控,不允許以任何形式私自生產、運輸和交易雷氧酸。