「鿬」:修訂間差異
imported>原神胡桃 無編輯摘要 |
PandaFiredoge(留言 | 貢獻) 無編輯摘要 |
||
| 第1行: | 第1行: | ||
{{真实存在| | {{真实存在|{{僻字|{{造字|left=石|right=田}}}}}}{{含有扩展区汉字|{{僻字|{{造字|left=石|right=田}}}}|1}}{{元素信息|title1=|名称={{僻字|{{造字|left=石|right=田}}}}|符号=Ts|原子序数=117|原子量=294(标准)|族=17族(卤族)|周期=7|常见同位素=Ts-294|原子半径=138 pm|密度=7.3 g·cm<sup>−3</sup>|颜色=黑色(蒸汽或有机溶剂的溶液为极深的蓝色)|硬度=4(莫氏硬度)|衰变方式=α(Ts-293,Ts-294)|半衰期=有锑场为18年,无锑场约为78毫秒|常见化合价='''-1''',0,+1,'''+3''',+5,+7|常见化合物=硫酸{{僻字|{{造字|left=石|right=田}}}}、硝酸{{僻字|{{造字|left=石|right=田}}}}、氧化{{僻字|{{造字|left=石|right=田}}}}、氢氧化{{僻字|{{造字|left=石|right=田}}}}、{{僻字|{{造字|left=石|right=田}}}}化氢、三氟化{{僻字|{{造字|left=石|right=田}}}}|升华点=|熔点=360°C|沸点=550°C}} | ||
''' | '''{{僻字|{{造字|left=石|right=田}}}}''',化学符号Ts,原子序数117,属于第七周期第十七族的类金属,具有一定放射性,常温下为钢灰色固体或黑晶体,具有金属光泽,沸点550°C,气态时为蓝黑色气体,因为熔点和沸点相差甚远,故无法表现出类似于[[碘]]因为熔沸点相近产生的假升华现象。它是许多星球人必须的微量元素,缺乏{{僻字|{{造字|left=石|right=田}}}}可能会导致思维迟钝,并且易于被锑化。由于{{僻字|{{造字|left=石|right=田}}}}的性质和金属类似,所以锑星人将其命名为“钿”,但是地球人由于不知道其性质,根据卤素将其命名为“{{僻字|{{造字|left=石|right=田}}}}”。 | ||
== 稳定性 == | == 稳定性 == | ||
在[[锑星]]上, | 在[[锑星]]上,{{僻字|{{造字|left=石|right=田}}}}在锑场作用下,放射性削弱,稳定性大大增强,半衰期达到18年,会α衰变为[[镆]]-260。而在{{僻字|{{造字|left=石|right=田}}}}星上,由于有极为强大的{{僻字|{{造字|left=石|right=田}}}}场的存在,{{僻字|{{造字|left=石|right=田}}}}是稳定元素,根本就没有什么放射性。 | ||
== 来源 == | == 来源 == | ||
在锑宙中含量极低,以Ts<sup>3+</sup>( | 在锑宙中含量极低,以Ts<sup>3+</sup>({{僻字|{{造字|left=石|right=田}}}}离子,强酸性条件)和Ts(OH)<sub>2</sub><sup>+</sup>(碱式{{僻字|{{造字|left=石|right=田}}}}离子)的形式存在于[[卤素星系]]的某些碱性放射性盐湖中,或以[[高石田酸|高{{僻字|{{造字|left=石|right=田}}}}酸]]的形式存在于[[氟王水湖]]中,工业上常常使用无理核反应或文字守恒定律制备 | ||
目前,[[锑星]]和[[卤素星系]]都是生产这种物质的大户,甚至成了[[碘星]]和[[砹星]]某些省的支柱产业, | 目前,[[锑星]]和[[卤素星系]]都是生产这种物质的大户,甚至成了[[碘星]]和[[砹星]]某些省的支柱产业,{{僻字|{{造字|left=石|right=田}}}}目前主要用于医药,放射治疗,金属精炼,合金制造等行业。 | ||
==理化性质== | ==理化性质== | ||
<blockquote>''详见:[[超理文献:石田元素超理学|{{造字|left=石|right=田}}元素超理学]]''</blockquote> | <blockquote>''详见:[[超理文献:石田元素超理学|{{造字|left=石|right=田}}元素超理学]]''</blockquote>{{僻字|{{造字|left=石|right=田}}}}与17族其他元素相同,它能以-1,0,+1,+3,+5,+7价稳定存在,锑场降低了它的原子半径而提高其电负性。另外,由于114号元素[[𫓧]]原子结构的稳定性(Fl具有稀有气体性质),所以{{僻字|{{造字|left=石|right=田}}}}最稳定的化合价是-1价和+3价。由于超重元素具有的极强自旋-轨道作用,使得Ts的7s轨道特别稳定,并导致+7价的Ts极其不稳定,其他化合价也都不太稳定。 | ||
目前碲球上未知 | 目前碲球上未知{{僻字|{{造字|left=石|right=田}}}}到底是金属元素还是非金属元素,但是据地球人推测,{{僻字|{{造字|left=石|right=田}}}}的电负性小于氢的电负性,所以{{造字|left = 石|right = 田}}与氢反应后生成的是氢化{{僻字|{{造字|left=石|right=田}}}}(TsH),而不是{{僻字|{{造字|left=石|right=田}}}}化氢(HTs)。不过,锑星人发现,锑场下,它的原子半径受到一定缩小,它的电负性介于[[砹]]和[[氢]]之间,所以实际上生成的是{{僻字|{{造字|left=石|right=田}}}}化氢。 | ||
{{僻字|{{造字|left=石|right=田}}}}只具有两种同素异形体——灰{{僻字|{{造字|left=石|right=田}}}}(Ts<sub>2</sub>)和金属质地的白{{僻字|{{造字|left=石|right=田}}}}(Ts),类似于灰锡和白锡,后者更稳定。臭{{僻字|{{造字|left=石|right=田}}}}(Ts<sub>3</sub>)暂未被制得。 | |||
[[File:Trigonal-3D-balls.png|缩略图|三氟化 | [[File:Trigonal-3D-balls.png|缩略图|三氟化{{僻字|{{造字|left=石|right=田}}}}(气态时),因为{{僻字|{{造字|left=石|right=田}}}}的金属性,该物质在水中表现出一定离子化合物的性质]] | ||
{{僻字|{{造字|left=石|right=田}}}}可溶解在浓硝酸和浓硫酸当中溶解,形成硝酸{{僻字|{{造字|left=石|right=田}}}}(Ts(NO<sub>3</sub>)<sub>3</sub>)和硫酸{{僻字|{{造字|left=石|right=田}}}}(Ts<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>),它们都是无色针状固体,在水中部分水解为对应的碱式{{僻字|{{造字|left=石|right=田}}}}化合物,类似于铋,碱式{{僻字|{{造字|left=石|right=田}}}}化合物在水中溶解度极高,可以被金化铯还原为双原子{{僻字|{{造字|left=石|right=田}}}}或{{僻字|{{造字|left=石|right=田}}}}化物,亦或氢氧化亚{{僻字|{{造字|left=石|right=田}}}},与超氧化氢反应产生不稳定的{{僻字|{{造字|left=石|right=田}}}}酸(HTsO<sub>3</sub>),{{僻字|{{造字|left=石|right=田}}}}酸在常温下便会分解为{{僻字|{{造字|left=石|right=田}}}}化氢和氧气。 | |||
{{僻字|{{造字|left=石|right=田}}}}因为电负性较弱,表现出许多金属的性质,例如{{僻字|{{造字|left=石|right=田}}}}单质已经能以金属质地存在,并且其中{{僻字|{{造字|left=石|right=田}}}}原子呈现简单的立方堆积,且TsOH并不是碱性物质,而是一种微溶于水的两性氢氧化物,可以同时电离出Ts<sup>+</sup>和TsO<sup>-</sup>;氢氧化{{僻字|{{造字|left=石|right=田}}}}Ts(OH)<sub>3</sub>则是易溶于水的三元碱和一元强碱,后两级电离都很弱,只有在饱和的CsOH溶液中才会微量形成TsO<sub>2</sub><sup>-</sup>,而TsO<sub>2</sub><sup>-</sup>是一种超强碱。 | |||
[[高 | [[高{{僻字|{{造字|left=石|right=田}}}}酸|HTsO<sub>4</sub>]]、H<sub>5</sub>TsO<sub>6</sub>、H<sub>7</sub>TsO<sub>7</sub>、TsO<sub>3</sub>F和TsF<sub>7</sub>是该元素最高价化合物,均极其不稳定,第三者最稳定,可以在低温惰性气体条件下保存数十日,可以剧烈的氧化有机物,是很危险的物质。 | ||
==获取方法== | ==获取方法== | ||
[[圆]](Yr)会自发进行α衰变,成为 | [[圆]](Yr)会自发进行α衰变,成为{{僻字|{{造字|left=石|right=田}}}}化氢,但由于圆很罕见,所以在公元1250年[[赵明毅]]利用锑场,对铊和砷[[发功]],成功制取了{{僻字|{{造字|left=石|right=田}}}}。反应如下: | ||
2Tl+2As=发功=Ts<sub>2</sub>+2Al | 2Tl+2As=发功=Ts<sub>2</sub>+2Al | ||
除此之外,对锇钍合金发功也可以制取 | 除此之外,对锇钍合金发功也可以制取{{僻字|{{造字|left=石|right=田}}}},这是目前锑星制取{{僻字|{{造字|left=石|right=田}}}}较为常用但成本较高的方法: | ||
2Os+2Th=发功=Ts<sub>2</sub>+2Ho | 2Os+2Th=发功=Ts<sub>2</sub>+2Ho | ||
这两个反应遭到了[[文字守恒管制协会]]的强烈谴责,原因是滥用文字守恒。{{元素周期表简表}} | 这两个反应遭到了[[文字守恒管制协会]]的强烈谴责,原因是滥用文字守恒。{{元素周期表简表}} | ||
於 2024年3月16日 (六) 07:52 的修訂
- 本頁面含有Unicode擴展區漢字:,如果您的設備無法顯示,請點擊此處,以便標題和內容能正常顯示。
,化學符號Ts,原子序數117,屬於第七周期第十七族的類金屬,具有一定放射性,常溫下為鋼灰色固體或黑晶體,具有金屬光澤,沸點550°C,氣態時為藍黑色氣體,因為熔點和沸點相差甚遠,故無法表現出類似於碘因為熔沸點相近產生的假升華現象。它是許多星球人必須的微量元素,缺乏可能會導致思維遲鈍,並且易於被銻化。由於的性質和金屬類似,所以銻星人將其命名為「鈿」,但是地球人由於不知道其性質,根據鹵素將其命名為「」。
穩定性
在銻星上,在銻場作用下,放射性削弱,穩定性大大增強,半衰期達到18年,會α衰變為鏌-260。而在星上,由於有極為強大的場的存在,是穩定元素,根本就沒有什麼放射性。
來源
在銻宙中含量極低,以Ts3+(離子,強酸性條件)和Ts(OH)2+(鹼式離子)的形式存在於鹵素星系的某些鹼性放射性鹽湖中,或以高酸的形式存在於氟王水湖中,工業上常常使用無理核反應或文字守恆定律製備
目前,銻星和鹵素星系都是生產這種物質的大戶,甚至成了碘星和砹星某些省的支柱產業,目前主要用於醫藥,放射治療,金屬精煉,合金製造等行業。
理化性質
詳見:元素超理學
與17族其他元素相同,它能以-1,0,+1,+3,+5,+7價穩定存在,銻場降低了它的原子半徑而提高其電負性。另外,由於114號元素鈇原子結構的穩定性(Fl具有稀有氣體性質),所以最穩定的化合價是-1價和+3價。由於超重元素具有的極強自旋-軌道作用,使得Ts的7s軌道特別穩定,並導致+7價的Ts極其不穩定,其他化合價也都不太穩定。
目前碲球上未知到底是金屬元素還是非金屬元素,但是據地球人推測,的電負性小於氫的電負性,所以與氫反應後生成的是氫化(TsH),而不是化氫(HTs)。不過,銻星人發現,銻場下,它的原子半徑受到一定縮小,它的電負性介於砹和氫之間,所以實際上生成的是化氫。
只具有兩種同素異形體——灰(Ts2)和金屬質地的白(Ts),類似於灰錫和白錫,後者更穩定。臭(Ts3)暫未被製得。
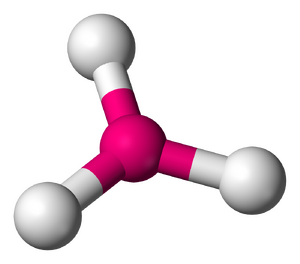
可溶解在濃硝酸和濃硫酸當中溶解,形成硝酸(Ts(NO3)3)和硫酸(Ts2(SO4)3),它們都是無色針狀固體,在水中部分水解為對應的鹼式化合物,類似於鉍,鹼式化合物在水中溶解度極高,可以被金化銫還原為雙原子或化物,亦或氫氧化亞,與超氧化氫反應產生不穩定的酸(HTsO3),酸在常溫下便會分解為化氫和氧氣。
因為電負性較弱,表現出許多金屬的性質,例如單質已經能以金屬質地存在,並且其中原子呈現簡單的立方堆積,且TsOH並不是鹼性物質,而是一種微溶於水的兩性氫氧化物,可以同時電離出Ts+和TsO-;氫氧化Ts(OH)3則是易溶於水的三元鹼和一元強鹼,後兩級電離都很弱,只有在飽和的CsOH溶液中才會微量形成TsO2-,而TsO2-是一種超強鹼。
[[高酸|HTsO4]]、H5TsO6、H7TsO7、TsO3F和TsF7是該元素最高價化合物,均極其不穩定,第三者最穩定,可以在低溫惰性氣體條件下保存數十日,可以劇烈的氧化有機物,是很危險的物質。
獲取方法
圓(Yr)會自發進行α衰變,成為化氫,但由於圓很罕見,所以在公元1250年趙明毅利用銻場,對鉈和砷發功,成功製取了。反應如下:
2Tl+2As=發功=Ts2+2Al
除此之外,對鋨釷合金髮功也可以製取,這是目前銻星製取較為常用但成本較高的方法:
2Os+2Th=發功=Ts2+2Ho
這兩個反應遭到了文字守恆管制協會的強烈譴責,原因是濫用文字守恆。
| 元素周期表 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
<tabber>複數周期=
|
