「雷氧酸」:修訂間差異
imported>Hydrogen Sulfide 创建页面,内容为“'''雷氧酸'''(Fulminoxylic acid),化学式HCNO<sub>2</sub>,又名氰(III)酸(Cyanic(III) acid),即氰的+3价含氧酸,拥有多种同分异构体。雷氧酸及其盐均是易爆炸化学品。与其他卤素的+3价含氧酸相似,雷氧酸极端不稳定。雷氧酸是中强酸,具有弱还原性。 ==制备== 将液态氰化氢与液氧在低温高压下等摩尔混合,加入氰化三氢(H3CN)作催化剂,即可生成雷氧酸…” |
imported>Hydrogen Sulfide 小 →氧化还原性 |
||
| (未顯示由 2 位使用者於中間所作的 22 次修訂) | |||
| 第1行: | 第1行: | ||
'''雷氧酸'''(Fulminoxylic acid),化学式HCNO<sub>2</sub>,又名氰(III)酸(Cyanic(III) acid),即氰的+3价含氧酸,拥有多种同分异构体。雷氧酸及其盐均是易爆炸化学品。与其他卤素的+3价含氧酸相似,雷氧酸极端不稳定。雷氧酸是中强酸,具有弱还原性。 | {{Notice|纪念:本页面为本wiki第2500个内容页面。|orange|white|5=orange}}{{包含非超理内容}}{{半管制品}}{{化合物性质模版|别名=氰(III)酸|smiles=OC#[N+][O-]|化学式=HCNO<sub>2</sub>|摩尔质量=59.024g/mol|密度=1.14g/cm<sup>3</sup>|pka=2.66|溶解性(水)=0.032mol/L|相关化学品=HClO<sub>2</sub>、HCNO、HCNO<sub>4</sub>|外观=无色液体|气味=苦杏仁味|分子结构=角形}} | ||
'''雷氧酸'''(Fulminoxylic acid),化学式HCNO<sub>2</sub>,又名氰(III)酸(Cyanic(III) acid),即[[氰]]的+3价含氧酸,拥有多种同分异构体。雷氧酸及其盐均是易爆炸化学品。与其他卤素的+3价含氧酸相似,雷氧酸极端不稳定。雷氧酸是中强酸,具有弱还原性。 | |||
==制备== | ==制备== | ||
将液态氰化氢与液氧在低温高压下等摩尔混合,加入氰化三氢(H3CN)作催化剂,即可生成雷氧酸: | 将液态[[氰化氢]]与液氧在低温高压下等摩尔混合,加入氰化三氢(H3CN)作催化剂,即可生成雷氧酸: | ||
HCN+O<sub>2</sub>====HCNO<sub>2</sub> | HCN+O<sub>2</sub>====HCNO<sub>2</sub> | ||
| 第9行: | 第10行: | ||
==结构== | ==结构== | ||
[[File:HCNO2.png|200px|right]] | |||
雷氧酸一般的结构为HO-C<sup>-</sup>=N<sup>+</sup>=O,即雷酸中的氢被羟基取代。此外,雷氧酸有至少4种同分异构体。 | 雷氧酸一般的结构为HO-C<sup>-</sup>=N<sup>+</sup>=O,即雷酸中的氢被羟基取代。此外,雷氧酸有至少4种同分异构体。 | ||
#异雷氧酸:即羟亚氨基甲酮(Hydroxyliminomethanone),结构为HO-N=C=O | #过氧氰酸(Peroxycyanic acid):结构为HO-O-CN。<ref>[https://pubchem.ncbi.nlm.nih.gov/compound/18627785 PubChem 18627785]</ref> | ||
#亚硝基甲醛(Nitrosoformaldehyde):结构为O=CH-N=O。 | #异雷氧酸:即羟亚氨基甲酮(Hydroxyliminomethanone),结构为HO-N=C=O。<ref>[https://www.chemspider.com/Chemical-Structure.10606725.html ChemSpider 10606725]</ref> | ||
#亚硝基甲醛(Nitrosoformaldehyde):结构为O=CH-N=O。<ref>[https://www.chemspider.com/Chemical-Structure.15110399.html ChemSpider 15110399]</ref> | |||
# | #羰基硝酮(Ketonitrone),结构为O<sup>+</sup>≡C-NH-O<sup>-</sup>。<ref>[https://www.chemspider.com/Chemical-Structure.25936517.html ChemSpider 25936517]</ref> | ||
#λ<sup>6</sup>-亚氨基甲二酮,结构为HN=C(=O)=O。 | |||
上述结构的稳定性依次为:OCHNO > HONCO > OCNHO > HNCOO > HOCNO。 | |||
==化学性质== | |||
===酸性=== | |||
雷氧酸的pKa为2.66,属于中强酸。纯净的雷氧酸尚未制得。 | |||
===不稳定性=== | |||
雷氧酸极不稳定,且易爆炸。标准条件下半衰期约为320s,分解产物多样,以氰化氢、氧气、一氧化碳、氮气、水为主。雷氧酸的分解反应和亚氯酸相似。 | |||
{| class="wikitable" | |||
! 雷氧酸分解 !! 亚氯酸分解 | |||
|- | |||
| {{Chem|8HCNO2 = 6CO↑+6NO↑+(CN)2↑+2H2O}} || {{Chem|8HClO2 = 6ClO2↑+Cl2↑+2H2O}} | |||
|- | |||
| {{Chem|HCNO2 = HCN↑+O2↑}} || {{Chem|HClO2 = HCl↑+O2↑}} | |||
|- | |||
| {{Chem|3HCNO2 = 2NOCOOH+HCN↑}} || {{Chem|3HClO2 = 2HClO3+HCl↑}} | |||
|- | |||
| {{Chem|2HCNO2 = [[高氰酸|NO2COOH]]+HCN↑}} || {{Chem|2HClO2 = HClO4+HCl↑}} | |||
|- | |||
| {{Chem|2HCNO2 = H2O2+(CN)2↑+O2↑}} || {{Chem|2HClO2 = H2O2+Cl2↑+O2↑}} | |||
|} | |||
===氧化还原性=== | |||
雷氧酸中C为+4价,N为-1价,因此有一定还原性,被氧化后生成二氧化碳和氮气。 | |||
4HCNO<sub>2</sub>+SO<sub>2</sub>===4CO<sub>2</sub>+2N<sub>2</sub>+S+2H<sub>2</sub>O | |||
碱性条件下,雷氧酸盐也有氧化性,产物可能是CN<sup>-</sup>、OCN<sup>-</sup>或NH<sub>3</sub>。 | |||
KCNO<sub>2</sub>+4KI+2H<sub>2</sub>O===KCN+4KOH+2I<sub>2</sub>↓ | |||
KCNO<sub>2</sub>+K<sub>2</sub>SO<sub>3</sub>==KOCN+K<sub>2</sub>SO<sub>4</sub> | |||
===水解性=== | |||
雷氧酸水解生成硝基甲烷,或二氧化碳和羟胺: | |||
{{Chem|HCNO2+H2O=CH3NO2}} | |||
{{Chem|HCNO2+H2O=CO2+NH2OH}} | |||
前一个反应的标准平衡常数K=125.5,后者则是K=10.85。 | |||
==用途== | |||
雷氧酸及其盐目前没有实际用途。某些星球计划将其作为炸药使用,但因为其毒性而难以实现。 | |||
==管控== | |||
雷氧酸及其盐受到了著名超理学家委员会的较严格管控,不允许以任何形式私自生产、运输和交易雷氧酸。 | |||
==注释与参考== | |||
<references/> | |||
[[Category:酸]] | |||
[[Category:无机化合物]] | |||
[[Category:中强酸]] | |||
於 2025年3月15日 (六) 03:51 的最新修訂
雷氧酸(Fulminoxylic acid),化學式HCNO2,又名氰(III)酸(Cyanic(III) acid),即氰的+3價含氧酸,擁有多種同分異構體。雷氧酸及其鹽均是易爆炸化學品。與其他鹵素的+3價含氧酸相似,雷氧酸極端不穩定。雷氧酸是中強酸,具有弱還原性。
製備[編輯]
將液態氰化氫與液氧在低溫高壓下等摩爾混合,加入氰化三氫(H3CN)作催化劑,即可生成雷氧酸:
HCN+O2====HCNO2
這是一個可逆反應,在上述條件下的平衡常數K≈250.5。
結構[編輯]
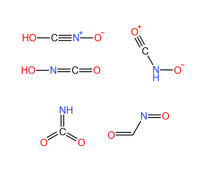
雷氧酸一般的結構為HO-C-=N+=O,即雷酸中的氫被羥基取代。此外,雷氧酸有至少4種同分異構體。
- 過氧氰酸(Peroxycyanic acid):結構為HO-O-CN。[1]
- 異雷氧酸:即羥亞氨基甲酮(Hydroxyliminomethanone),結構為HO-N=C=O。[2]
- 亞硝基甲醛(Nitrosoformaldehyde):結構為O=CH-N=O。[3]
- 羰基硝酮(Ketonitrone),結構為O+≡C-NH-O-。[4]
- λ6-亞氨基甲二酮,結構為HN=C(=O)=O。
上述結構的穩定性依次為:OCHNO > HONCO > OCNHO > HNCOO > HOCNO。
化學性質[編輯]
酸性[編輯]
雷氧酸的pKa為2.66,屬於中強酸。純淨的雷氧酸尚未製得。
不穩定性[編輯]
雷氧酸極不穩定,且易爆炸。標準條件下半衰期約為320s,分解產物多樣,以氰化氫、氧氣、一氧化碳、氮氣、水為主。雷氧酸的分解反應和亞氯酸相似。
| 雷氧酸分解 | 亞氯酸分解 |
|---|---|
| 8HCNO2=6CO↑+6NO↑+(CN)2↑+2H2O | 8HClO2=6ClO2↑+Cl2↑+2H2O |
| HCNO2=HCN↑+O2↑ | HClO2=HCl↑+O2↑ |
| 3HCNO2=2NOCOOH+HCN↑ | 3HClO2=2HClO3+HCl↑ |
| 2HCNO2=NO2COOH+HCN↑ | 2HClO2=HClO4+HCl↑ |
| 2HCNO2=H2O2+(CN)2↑+O2↑ | 2HClO2=H2O2+Cl2↑+O2↑ |
氧化還原性[編輯]
雷氧酸中C為+4價,N為-1價,因此有一定還原性,被氧化後生成二氧化碳和氮氣。
4HCNO2+SO2===4CO2+2N2+S+2H2O
鹼性條件下,雷氧酸鹽也有氧化性,產物可能是CN-、OCN-或NH3。
KCNO2+4KI+2H2O===KCN+4KOH+2I2↓
KCNO2+K2SO3==KOCN+K2SO4
水解性[編輯]
雷氧酸水解生成硝基甲烷,或二氧化碳和羥胺:
HCNO2+H2O=CH3NO2
HCNO2+H2O=CO2+NH2OH
前一個反應的標準平衡常數K=125.5,後者則是K=10.85。
用途[編輯]
雷氧酸及其鹽目前沒有實際用途。某些星球計劃將其作為炸藥使用,但因為其毒性而難以實現。
管控[編輯]
雷氧酸及其鹽受到了著名超理學家委員會的較嚴格管控,不允許以任何形式私自生產、運輸和交易雷氧酸。