| 序數 | -i | i | 2i | 3i | 4i | 5i | 更多 |
|---|---|---|---|---|---|---|---|
| 元素 | M 鉾Sb | Ch Sb | Dc Sb | Six 䃤Sb | Hon 鉷Sb | Zh 磚Sb | ...Sb |
釒炸(Bombium),也作鈼,是一種金屬元素,由鍩星著名超理學家、在逃通緝犯於傑418發現於鍩星。原子序數9.3,是非整數元素。
釒炸-19.6(唯一已知同位素)原子核中有9個質子,10個中子,1個上夸克和1個下夸克,但一般稱之為有9.3個質子和10.3個中子。釒炸有9個核外電子,電子排布和氟相同,但不同的是在L層多出了一個下夸克,這個游離的夸克賦予了釒炸極其活潑的性質。
由於核電荷數指的是原子核內的電荷,因此釒炸的核電荷數是9(質子)+0.6(上夸克)-0.3(下夸克)=9.3,而不是9。又因核電荷數=原子序數,釒炸的原子序數也是9.3。核外的下夸克所帶的電荷是一個電子的三分之一,因此核外電子數也看做9(電子)+0.3(下夸克)=9.3。釒炸離子則帶有10個電子,核外的下夸克則會進入原子核,但無法與核內的兩個夸克形成中子。
雖然釒炸的電負性高達8,但釒炸單質在標準狀態下是金黃色固體,並具有金屬光澤,這是由於游離的下夸克脫離原子並在晶體中形成類似金屬鍵的「夸克鍵」的緣故。儘管如此,釒炸單質仍然具有非常強的氧化性,且在有鍩場的環境下,它的氧化性會進一步增強,可以氧化絕大多數物質,例如:
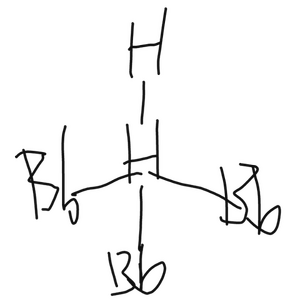
是一種超強酸,也就是釒炸化氫的溶液,H0=-26.6。氫釒炸酸可以與金反應,生成釒炸化金:
另外,釒炸化氫常溫下是一種反射率很低的液體,會大量吸收光;而這些光中攜帶的能量使得釒炸原子中的游離下夸克脫離原子核的束縛,形成了高度不穩定的釒炸陽離子(Bb0.3+,也寫作Bp,但與其他元素成鍵時寫作Bb),並產生劇烈的爆炸。因此,釒炸化氫必須儲存在棕色或黑色的試劑瓶中。
是最常用的鍩鍵物質之一,常溫下為氣體。鍩鍵是一種特殊的超理鍵,其本質是夸克鍵,可以在鍩場中產生。
由鍩單質在130℃以上的強鍩場環境下與釒炸反應製得。橘黃色液體,密度比水大。
同樣具有極強的氧化性。與玻璃、塑料、大部分金屬(銫除外)接觸都會發生爆炸。可用作火箭燃料。
即六釒炸化氮,是一種極度危險的氣體。只能在-20℃的溫度下穩定存在。高於此溫度時,則夸克鍵中的大量夸克可徹底脫離原子,並放出大量能量。由於其在常溫下只可以存在30秒,釒炸氮在以前經常被用作炸藥。銻歷0202年,泛銻宙聯合軍事委員會常務會議上禁止生產釒炸氮。因此,釒炸氮受到了著名超理學家委員會的嚴格管控,不允許以任何形式私自生產、銷售、運輸和交易釒炸氮。
其中氫顯+1價,氧被氧化成+2價,釒炸仍然顯-0.6價。熔點-51℃,沸點87℃,在常溫下為藍色液體。被分類為強腐蝕性的危險品。
H2OBb6的酸性並不是很強,它的飽和溶液的pH為0.15,但是它還是屬於強酸。有強烈腐蝕性,能夠腐蝕金、銥、鈦等金屬。腐蝕金會生成Au2(OBb6)9,即次釒炸酸金。腐蝕鈦生成Ti(OBb6)6,也就是次釒炸酸鈦。
為極易溶於水的鮮紅色液體,其中氧為+4價。熔點為-38℃,沸點為250℃,比重為4.38。亞釒炸酸的酸性極強,目前它屬於超強酸,飽和的H2OBb9溶液的pH為-10.91。其氧化性同樣極強,能夠與除氟外的其他117個非超理元素發生反應,生成相對應的鹽,例如在常溫下就能夠與鑽石劇烈反應生成亞釒炸酸碳。次釒炸酸能夠和釒炸單質反應生成亞釒炸酸。
H2OBb9能腐蝕鈦合金,生成TiOBb9,把鈦合金投入H2OBb9就好像泥牛入海一樣,會被腐蝕的無影無蹤。同時也能腐蝕硫酸鋇、硅酸。硫化汞以及氯化銀等難溶沉澱,也能夠溶解除了氦、氖和氬的大多數氣體。H2OBb9一般盛在超氯化銫製成的容器中,絕對不能用有機物或含硅化合物盛裝。H2OBb9的毒性超強,大約30毫克就能毒死一個70千克的成年人。
H2OBb9有脫水性,能力比濃硫酸還要強得多。濃硫酸即便在銻場下只能炭化木材,而在銻場下只要把亞釒炸酸滴在木頭上,釒炸原子核外的下夸克還會與銻場共同催化三個碳原子變成兩個水分子,發生較為溫和的核反應。另外,如果把電負性小於0.85的金屬投入H2OBb9會出現規模僅次於核爆炸的大爆炸。
冥鹼也就是三個釒炸陽離子(Bp)和氟離子通過離子鍵組成的化合物,化學式Bb3F。這種鹼常溫下是液體,熔點4.1K,沸點653.2K。
氟得到的這個電子並非來源於釒炸,因為兩個原子是通過電磁力(離子鍵)被束縛在一起的,因此實際上是氟與其他元素成鍵後得到的電子。
冥鹼是一種有強腐蝕性、強氧化性和劇毒的危險品,而且需要用特製的冥鹼加熱器才能加熱。冥鹼可以催化鹵素和惰性氣體的反應以及阻止中子衰變。
冥鹼帶一定鹼性(氫氧化釒炸理論上是強鹼),飽和溶液的pH約等於25,因此需要耐酸鹼的銻星版pH計來測量它的pH。
由於有釒炸陽離子,冥鹼的氧化性極強。根據銻星科學家的精確計算,冥鹼的氧化性大約是氟氣的20.87654320368倍,以至於冥鹼可以在加熱條件下與氦氣發生規模不亞於核爆的反應,生成二氟化氦(2Bb3F+He=加熱=6Bb+HeF2)。
冥鹼與有機物反應會生成釒炸化碳和氫氟酸:
冥酸不可以溶解惰性元素,但大量的冥鹼能夠溶解中子星的外層,生成一種特殊的配合物離子,俗稱㲴釒炸離子(BbNu3+)。其中,釒炸的下夸克進入原子核,每兩個L層電子與一個㲴原子結合,並失去多出的一個電子。
所有釒炸化合物中,最重要是與銻的化合物,其中最經典的是Sb2Bb153,即超釒炸化銻,其中銻顯+51價。
為少數不溶於水的釒炸化物之一。超釒炸化銻為綠色固體,售價為250銻幣/克,熔點25051℃,沸點51250℃。它的製取比較複雜:
它的分子結構是:153個釒炸原子排成「Bb」字型,失去全部電子的銻原子則在中間。
化學式SiBb6,俗名玻璃氣。釒炸化硅能溶於氫釒炸酸和氫氟酸,但是不與這些物質反應。溶於水能夠生成次釒炸酸亞硅,並放出有強還原性的一氧化三氫:SiBb6+3H2O==SiOBb6+2H3O。
同時,亞硅離子(+2價)具有氧化性,可以把一氧化三氫中的-3價氧變為-2價氧,並歧化生成硅單質和次釒炸酸硅:4SiOBb6+4H3O==2Si(OBb6)2+6H2O+2Si+O2。
六釒炸化硅的熔點是-250℃,沸點-87℃,在常溫下為有刺激性氣味的白色氣體,據稱吸入就「像喝了燙稀飯一樣感覺無比疼痛」。密度為5.5kg/m3,比熱容是水的51倍。
由於釒炸化碳氧化性比釒炸化硅弱,六釒炸化硅可以在銻場下與甲烷反應,生成六釒炸化碳和硅烷:SiBb6+CH4==CBb6+SiH4。
六釒炸化硅的氧化性比起其他化合物較弱,所需要在極高溫下才能與稀有氣體反應。
釒炸的很多化合物中都含有鍩鍵,這種鍵讓這些物質具有特殊的性質。鍩鍵的本質是游離下夸克組成的夸克鍵,鍩場使夸克打破了色禁閉,並讓它們的活動範圍達到了原子級別。當鍩場的範圍覆蓋整個分子時,夸克鍵便會變成鍩鍵,靠強相互作用維持分子;一旦鍩場的範圍縮小到原子核,這些鍩鍵就會斷裂,所有夸克回歸原子核,於是分子分解成大量自由基。
| 元素周期表 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||